Новости Патентных Технологий
Только интересные новости из мира изобретений, инноваций, патентов, софта, товарных знаков, брендов, авторских прав и интеллектуальной собственности. Патентные ведомства: ФИПС. Роспатент, ЕАПО, EPO, WIPO

18.08.2023
Граф Дракула воскрес: Ученые пролили новый свет на легендарную фигуру, стоящую за королем вампиров
Влад III, часто называемый Владом Цепешем, был принцем и полководцем 15-го века, чья устрашающая репутация, как полагают, вдохновила на создание литературного вампира графа Дракулы. Теперь научная экспертиза его писем дает новое представление о его здоровье. Исследователи, которые сейчас публикуются в журнале ACS "Аналитическая химия", говорят, что результаты свидетельствуют о том, что у Влада, вероятно, были кожные заболевания и респираторные заболевания, и он мог даже плакать в буквальном смысле кровавыми слезами.

18.08.2023
Подготовка к работе в условиях микрогравитации: упражнения, физика и роботизированные инновации на МКС
Ормузский пролив соединяет Оманский залив с Персидским заливом на этой фотографии с Международной космической станции, когда она находилась на орбите в 262 милях над землей 14 августа 2023 года. На переднем плане справа - корабль с экипажем "Союз МС-23", пристыкованный к стыковочному модулю "Причал". Слева внизу изображена часть космического грузового корабля Northrop Grumman Cygnus и одна из его ультралегких солнечных батарей в форме тарелки.

18.08.2023
Открытие Ледяного человека: Расширенный генетический анализ “Оци” раскрывает удивительные родовые корни и внешность
Оци, также известный как Ледяной человек, повторно секвенировал свой геном с помощью передовых технологий, что показало, что у него было больше общих генов с ранними анатолийскими фермерами, чем у других европейцев его времени. Вопреки прежним представлениям, у Оци сильно выпадали волосы, возможно, он был лысым, и у него был заметно более темный оттенок кожи, чем считалось ранее. Более того, в то время как его гены указывали на предрасположенность к ожирению и диабету, его активный образ жизни, вероятно, противодействовал этим генетическим тенденциям. Фото: Археологический музей Южного Тироля Марко Самаделли-Грегор Сташиц
18.08.2023
Десятилетия разработки – Новый синтетический антибиотик способен победить даже самые стойкие бактерии
Научное исследование, проводившееся десятилетиями в Университете Дьюка, открыло новый антибиотический подход к борьбе с грамотрицательными бактериями, включая сальмонеллу, псевдомонаду и кишечную палочку, которые часто являются причиной инфекций мочевыводящих путей (ИМП). Синтетическая молекула работает быстро и долговечна в тестах на животных.
Он работает, препятствуя способности бактерии создавать свой внешний липидный слой, так сказать, кожу.
“Если вы нарушите синтез бактериальной внешней мембраны, бактерии не смогут выжить без нее”, - сказал ведущий исследователь Пэй Чжоу, профессор биохимии в Медицинской школе Дьюка. “Наше соединение очень хорошее и очень действенное”.
Соединение, получившее название LPC-233, представляет собой небольшую молекулу, которая доказала свою эффективность в разрушении биосинтеза липидов внешней мембраны у каждой грамотрицательной бактерии, против которой оно было протестировано. Соавторы из Университета Лилля во Франции протестировали его на коллекции из 285 штаммов бактерий, включая некоторые, обладающие высокой устойчивостью к вирусам
Нет результатов, уточните запрос

14.08.2023
НОВОСТИ ДОМАШНЕГО ПРОСТРАНСТВА
Убедительные доказательства модифицированной гравитации: крах теорий Ньютона и Эйнштейна при низком ускорении
Исследование орбитальных движений больших двойных систем обнаружило доказательства того, что стандартная гравитация разрушается при низких ускорениях. Это открытие согласуется с модифицированной теорией под названием MOND и бросает вызов современным представлениям о темной материи. Последствия для астрофизики, физики и космологии огромны, и полученные результаты были признаны экспертами в этой области значительным открытием.

14.08.2023
Переосмысление звука в космосе: физики демонстрируют, как звук может пересекать вакуум?
Культовый фильм “Чужой” однажды утверждал: "В космосе никто не услышит, как ты кричишь". Однако физики Жуоран Генг и Илари Маасилта из центра нанонауки при Университете Ювяскюля, Финляндия, с этим не согласны. Их недавнее исследование показывает, что при определенных условиях звук действительно может мощно передаваться через вакуум.
Подробнее
14.08.2023
"Квантовая лавина” – явление, которое может произвести революцию в микроэлектронике и суперкомпьютерах
Исследование изучало переходы между изолятором и металлом, выявляя несоответствия в традиционной формуле Ландау-Зенера и предлагая новое понимание резистивной коммутации. Используя компьютерное моделирование, исследование высвечивает задействованную квантовую механику и предполагает, что электронное и тепловое переключение могут возникать одновременно, что потенциально может найти применение в микроэлектронике и нейроморфных вычислениях.
Рассматривая только их субатомные частицы, большинство материалов можно отнести к одной из двух категорий.
Металлы, такие как медь и железо, обладают свободными электронами, которые позволяют им проводить электричество, в то время как изоляторы, такие как стекло и резина, удерживают свои электроны плотно связанными и, следовательно, не проводят электричество.
Изоляторы могут превращаться в металлы при воздействии интенсивного электрического поля, открывая заманчивые возможности для микроэлектроники и суперкомпьютерных вычислений, но физика, лежащая в основе этого явления, называемого резистивным переключением, изучена недостаточно хорошо.
Рассматривая только их субатомные частицы, большинство материалов можно отнести к одной из двух категорий.
Металлы, такие как медь и железо, обладают свободными электронами, которые позволяют им проводить электричество, в то время как изоляторы, такие как стекло и резина, удерживают свои электроны плотно связанными и, следовательно, не проводят электричество.
Изоляторы могут превращаться в металлы при воздействии интенсивного электрического поля, открывая заманчивые возможности для микроэлектроники и суперкомпьютерных вычислений, но физика, лежащая в основе этого явления, называемого резистивным переключением, изучена недостаточно хорошо.
Нет результатов, уточните запрос
22.06.2023
“Гидратационные твердые вещества”: новый класс науки о встряхивании материи
Недавнее исследование утверждает, что такие материалы, как древесина, бактерии и грибы, принадлежат к недавно выделенному классу веществ - “гидратированным твердым веществам”.
В течение многих лет в областях физики и химии придерживались мнения, что свойства твердых материалов фундаментально определяются атомами и молекулами, из которых они состоят. Например, кристаллическая природа соли объясняется ионной связью, образующейся между ионами натрия и хлорида. Аналогичным образом, металлы, такие как железо или медь, обязаны своей прочностью металлическим связям между соответствующими атомами, а эластичность каучуков обусловлена гибкими связями в образующих их полимерах. Этот принцип также применим к таким веществам, как грибы, бактерии и древесина.
По крайней мере, так гласит история.
В течение многих лет в областях физики и химии придерживались мнения, что свойства твердых материалов фундаментально определяются атомами и молекулами, из которых они состоят. Например, кристаллическая природа соли объясняется ионной связью, образующейся между ионами натрия и хлорида. Аналогичным образом, металлы, такие как железо или медь, обязаны своей прочностью металлическим связям между соответствующими атомами, а эластичность каучуков обусловлена гибкими связями в образующих их полимерах. Этот принцип также применим к таким веществам, как грибы, бактерии и древесина.
По крайней мере, так гласит история.
Нет результатов, уточните запрос

14.05.2023
Воздушные шары на солнечных батареях улавливают таинственные звуки неизвестного происхождения в стратосфере Земли
Недорогие и простые в изготовлении, эти аэростаты для сбора данных улавливают низкочастотный звук в атмосфере Земли.
Представьте, что для отправки вашего научного эксперимента на высоту 70 000 футов в воздух потребовались только пластик, клейкая лента, щепотка угольной пыли и много солнечного света.
Дэниел Боуман из Национальной лаборатории Сандии представил свои выводы об использовании воздушных шаров на солнечных батареях для подслушивания стратосферных звуков на 184-м заседании Американского акустического общества.
Представьте, что для отправки вашего научного эксперимента на высоту 70 000 футов в воздух потребовались только пластик, клейкая лента, щепотка угольной пыли и много солнечного света.
Дэниел Боуман из Национальной лаборатории Сандии представил свои выводы об использовании воздушных шаров на солнечных батареях для подслушивания стратосферных звуков на 184-м заседании Американского акустического общества.
Нет результатов, уточните запрос

06.05.2023
AMaLiS 2.0: новая концепция электрификации литий-воздушных аккумуляторов
Так называемые литий-воздушные батареи, также известные как литий-кислородные батареи, являются кандидатами на создание следующего поколения устройств хранения электроэнергии с высокой энергией. Исследовательский проект AMaLiS 2.0 тестирует новую концепцию для увеличения стабильности и срока службы аккумуляторных элементов. Команда проекта сосредоточена на разделении положительных и отрицательных электродов с помощью мембраны, покрытой с обеих сторон. Это означает, что с обеих сторон можно использовать разные электролиты. Кроме того, исследователи хотят протестировать новый газодиффузионный электрод, изготовленный из наноструктурированного карбида титана.
Нет результатов, уточните запрос

03.05.2023
Революционизирующие квантовые схемы: точное проектирование с использованием графена
Ученые из CiQUS, ICN2, Университета Кантабрии, DIPC и DTU объединяют усилия для разработки универсального метода построения углеродных наноцепей по кирпичикам с настраиваемыми свойствами.
Возможные области применения включают будущие электронные устройства, схемы для квантовых компьютеров и термоэлектрические наноматериалы для возобновляемых источников энергии.
Возможные области применения включают будущие электронные устройства, схемы для квантовых компьютеров и термоэлектрические наноматериалы для возобновляемых источников энергии.
Нет результатов, уточните запрос
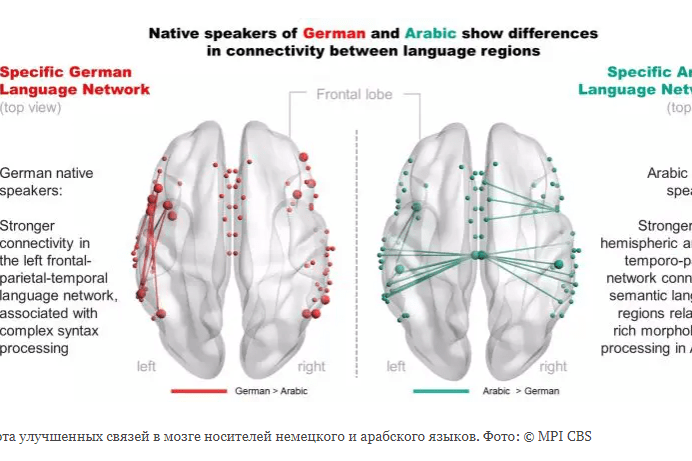
23.03.2022
Язык, на котором мы говорим, формирует связь в нашем мозге
Язык, на котором мы говорим, формирует связь в нашем мозге
Темы:МозгЯзыкИнститут Макса ПланкаНейронаука
Институт КОГНИТИВНЫХ НАУК ЧЕЛОВЕКА И МОЗГА МАКСА ПЛАНКА 21 МАРТА 2023 Г.
Структурный языковой коннектом
Ученые проанализировали структурный языковой коннектом носителей немецкого и арабского языков. Фото: © MPI CBS
Темы:МозгЯзыкИнститут Макса ПланкаНейронаука
Институт КОГНИТИВНЫХ НАУК ЧЕЛОВЕКА И МОЗГА МАКСА ПЛАНКА 21 МАРТА 2023 Г.
Структурный языковой коннектом
Ученые проанализировали структурный языковой коннектом носителей немецкого и арабского языков. Фото: © MPI CBS
Нет результатов, уточните запрос

15.03.2022
Новое исследование ставит под сомнение давно устоявшуюся стандартную модель электропорации
Мощные электрические поля обладают способностью образовывать поры в биологических мембранах посредством процесса, называемого электропорацией. Преднамеренное создание этих дефектов в мембранах является важнейшим методом не только в медицине и биотехнологии, но и при обработке пищевых продуктов.
Франко-немецкая исследовательская группа, возглавляемая доктором Карлосом Маркесом из Высшей нормальной школы в Лионе, Франция, и профессором доктором Яном Берендсом из Института физиологии Фрайбургского университета, недавно собрала данные, которые ставят под сомнение то, что десятилетиями считалось стандартной моделью этого механизма.
“Это вызов для построения теории и численного моделирования в этой области”, - говорит Маркес. Результаты теперь опубликованы в Трудах Академии наук Соединенных Штатов Америки (PNAS). Они могут помочь улучшить транспорт активных веществ в клетках.
Терапевтические вещества попадают в клетки через электропоры
Электрические поля постоянного тока выше определенной интенсивности нарушают организацию липидов, жироподобных молекул, которые образуют основную структуру биологических мембран в бислое, уложенных вместе в виде жидкого кристалла. Образующиеся электропоры, которые обычно стабильны только в течение очень короткого времени, позволяют воде и растворенным веществам из окружающей среды, таким как лекарства или другие активные вещества, включая РНК или ДНК, проникать в клетку.
Поскольку бислой липидов очень тонкий, размером всего в пять миллионных долей миллиметра, нет необходимости применять очень высокие напряжения для создания очень высокой напряженности поля (вольт на метр). Таким образом, даже при напряжении 0,1 вольта на мембране напряженность поля составляет 20 миллионов вольт на метр. Например, в воздухе искровой разряд уже происходит при трех миллионах вольт на метр. Однако это должно быть напряжение постоянного тока; поля переменного тока в диапазоне мегагерц-гигагерц, такие как те, которые генерируются сотовыми телефонами, не вызывают пор. Хотя метод хорошо зарекомендовал себя, все еще существует необходимость оптимизировать электропорацию клеточных мембран для различных целей, таких как введение генетического материала для генной терапии. Для этого важно точно понять механизм образования пор под действием электрических полей.
Стандартная модель с небольшой экспериментальной проверкой
Стандартная теоретическая модель электропорации 1970-х годов предполагает, что электрическое поле оказывает давление на липиды, тем самым увеличивая вероятность образования пор. Однако пока существует лишь небольшая экспериментальная проверка модели. Это связано, во-первых, с трудностью прямого обнаружения образования электропор и, во-вторых, с необходимостью проведения очень большого количества таких экспериментов для получения статистически обоснованных выводов. Это связано с тем, что, в отличие от пор, образованных белками, электропоры проявляют очень разнообразное, менее стереотипное поведение.
Методом, который способен обнаруживать образование пор с большой точностью и высоким временным разрешением, является электрическое измерение ионного тока. Ионы являются положительно или отрицательно заряженными составляющими солей, присутствующих во всех биологических жидкостях и, следовательно, внутри и снаружи клетки. Они практически не способны проникать через неповрежденные мембраны, но как только поры открываются, они переносятся через них в электрическом поле. Этот перенос заряженных частиц можно измерить с помощью высокочувствительных усилителей в виде крошечного электрического тока от нескольких миллиардных до миллионных долей ампера. Для этой цели искусственные липидные бислои создаются в тонких слоях тефлона через крошечные отверстия диаметром около 0,1 миллиметра и помещаются между двумя электродами. Этот метод формирования мембран очень подвержен разрушению - за раз формируется только одна мембрана, которая легко разрушается, особенно во время испытаний с более высоким напряжением.
Новый метод создания липидных слоев
Для своих экспериментов исследовательская группа использовала микрочип со множеством отверстий, с помощью которого можно очень быстро и многократно создавать значительно более стабильные липидные слои, используя упрощенные процедуры. Эта так называемая матрица микроэлектродных резонаторов (MECA) была разработана исследовательской группой Яна Берендса и была произведена и коммерчески доступна фрайбургской стартап-компанией Ionera Technologies GmbH, основанной в 2014 году.
С помощью этого устройства докторант Элали Лафарж из Института Шарля Садрона при Страсбургском университете и доктор Екатерина Зайцева из исследовательской группы Фрайбурга смогли создать сотни мембран за относительно короткое время, а также измерить и количественно оценить образование пор в зависимости от прочности материала.поле постоянного тока.
Результаты показали, что, вопреки предсказанию старой стандартной модели, энергетический барьер для образования пор уменьшается не с квадратом напряженности поля, а пропорционально напряженности поля. Другими словами, удвоение напряженности поля снижает энергетический барьер только наполовину, а не в четыре раза. Это предполагает принципиально иной механизм: дестабилизацию границы раздела между липидом и водой из-за переориентации молекул воды в электрическом поле.
Окисленные мембраны также изучались
Этот результат был также подтвержден для мембран, липиды которых были окислены в разной степени. Это интересно, потому что окисление липидов является естественным процессом регуляции функции клеточных мембран и играет роль в естественном старении организма и, возможно, также при таких заболеваниях, как болезнь Паркинсона и болезнь Альцгеймера. “Особенно учитывая медицинскую значимость этой темы, мы хотим продолжить ее изучение, включая оптические методы, чтобы достичь реального понимания этого важного явления”, - говорит Берендс.
Ссылка: “Энергия активации для открытия пор в липидных мембранах под действием электрического поля” Элали Дж. Лафарж, Пьер Мюллер, Андре П. Шредер, Екатерина Зайцева, Ян К. Берендс и Карлос М. Маркес, 7 марта 2023 года, Труды Национальной академии наук.
DOI: 10.1073 / pnas.221311220
Франко-немецкая исследовательская группа, возглавляемая доктором Карлосом Маркесом из Высшей нормальной школы в Лионе, Франция, и профессором доктором Яном Берендсом из Института физиологии Фрайбургского университета, недавно собрала данные, которые ставят под сомнение то, что десятилетиями считалось стандартной моделью этого механизма.
“Это вызов для построения теории и численного моделирования в этой области”, - говорит Маркес. Результаты теперь опубликованы в Трудах Академии наук Соединенных Штатов Америки (PNAS). Они могут помочь улучшить транспорт активных веществ в клетках.
Терапевтические вещества попадают в клетки через электропоры
Электрические поля постоянного тока выше определенной интенсивности нарушают организацию липидов, жироподобных молекул, которые образуют основную структуру биологических мембран в бислое, уложенных вместе в виде жидкого кристалла. Образующиеся электропоры, которые обычно стабильны только в течение очень короткого времени, позволяют воде и растворенным веществам из окружающей среды, таким как лекарства или другие активные вещества, включая РНК или ДНК, проникать в клетку.
Поскольку бислой липидов очень тонкий, размером всего в пять миллионных долей миллиметра, нет необходимости применять очень высокие напряжения для создания очень высокой напряженности поля (вольт на метр). Таким образом, даже при напряжении 0,1 вольта на мембране напряженность поля составляет 20 миллионов вольт на метр. Например, в воздухе искровой разряд уже происходит при трех миллионах вольт на метр. Однако это должно быть напряжение постоянного тока; поля переменного тока в диапазоне мегагерц-гигагерц, такие как те, которые генерируются сотовыми телефонами, не вызывают пор. Хотя метод хорошо зарекомендовал себя, все еще существует необходимость оптимизировать электропорацию клеточных мембран для различных целей, таких как введение генетического материала для генной терапии. Для этого важно точно понять механизм образования пор под действием электрических полей.
Стандартная модель с небольшой экспериментальной проверкой
Стандартная теоретическая модель электропорации 1970-х годов предполагает, что электрическое поле оказывает давление на липиды, тем самым увеличивая вероятность образования пор. Однако пока существует лишь небольшая экспериментальная проверка модели. Это связано, во-первых, с трудностью прямого обнаружения образования электропор и, во-вторых, с необходимостью проведения очень большого количества таких экспериментов для получения статистически обоснованных выводов. Это связано с тем, что, в отличие от пор, образованных белками, электропоры проявляют очень разнообразное, менее стереотипное поведение.
Методом, который способен обнаруживать образование пор с большой точностью и высоким временным разрешением, является электрическое измерение ионного тока. Ионы являются положительно или отрицательно заряженными составляющими солей, присутствующих во всех биологических жидкостях и, следовательно, внутри и снаружи клетки. Они практически не способны проникать через неповрежденные мембраны, но как только поры открываются, они переносятся через них в электрическом поле. Этот перенос заряженных частиц можно измерить с помощью высокочувствительных усилителей в виде крошечного электрического тока от нескольких миллиардных до миллионных долей ампера. Для этой цели искусственные липидные бислои создаются в тонких слоях тефлона через крошечные отверстия диаметром около 0,1 миллиметра и помещаются между двумя электродами. Этот метод формирования мембран очень подвержен разрушению - за раз формируется только одна мембрана, которая легко разрушается, особенно во время испытаний с более высоким напряжением.
Новый метод создания липидных слоев
Для своих экспериментов исследовательская группа использовала микрочип со множеством отверстий, с помощью которого можно очень быстро и многократно создавать значительно более стабильные липидные слои, используя упрощенные процедуры. Эта так называемая матрица микроэлектродных резонаторов (MECA) была разработана исследовательской группой Яна Берендса и была произведена и коммерчески доступна фрайбургской стартап-компанией Ionera Technologies GmbH, основанной в 2014 году.
С помощью этого устройства докторант Элали Лафарж из Института Шарля Садрона при Страсбургском университете и доктор Екатерина Зайцева из исследовательской группы Фрайбурга смогли создать сотни мембран за относительно короткое время, а также измерить и количественно оценить образование пор в зависимости от прочности материала.поле постоянного тока.
Результаты показали, что, вопреки предсказанию старой стандартной модели, энергетический барьер для образования пор уменьшается не с квадратом напряженности поля, а пропорционально напряженности поля. Другими словами, удвоение напряженности поля снижает энергетический барьер только наполовину, а не в четыре раза. Это предполагает принципиально иной механизм: дестабилизацию границы раздела между липидом и водой из-за переориентации молекул воды в электрическом поле.
Окисленные мембраны также изучались
Этот результат был также подтвержден для мембран, липиды которых были окислены в разной степени. Это интересно, потому что окисление липидов является естественным процессом регуляции функции клеточных мембран и играет роль в естественном старении организма и, возможно, также при таких заболеваниях, как болезнь Паркинсона и болезнь Альцгеймера. “Особенно учитывая медицинскую значимость этой темы, мы хотим продолжить ее изучение, включая оптические методы, чтобы достичь реального понимания этого важного явления”, - говорит Берендс.
Ссылка: “Энергия активации для открытия пор в липидных мембранах под действием электрического поля” Элали Дж. Лафарж, Пьер Мюллер, Андре П. Шредер, Екатерина Зайцева, Ян К. Берендс и Карлос М. Маркес, 7 марта 2023 года, Труды Национальной академии наук.
DOI: 10.1073 / pnas.221311220
Нет результатов, уточните запрос

02.12.2022
Вебинар ВОИС: Интеллектуальная собственность для стартапов малых и средних предприятий
Информируем Вас о том, что 29 ноября состоится бесплатный вебинар ВОИС: Интеллектуальная собственность для малых и средних предприятий: Руководство по интеллектуальной собственности для стартапов
Данное руководство знакомит стартапы с основами интеллектуальной собственности (патентами, товарными знаками, авторскими правами и др.). (Информация о регистрации в конце статьи)
С помощью подробных методических рекомендаций, полезных примеров из практики и простых в использовании контрольных листов авторы рассказывают, как ИС помогает малым предприятиям сохранять свою конкурентоспособность и управлять рисками.
Пособие, предназначенное для стартапов, заинтересованных в выводе своих инновационных технологий на рынок, будет полезным для широкого круга предпринимателей, желающих изучить принципы системы ИС.
Мероприятие проводится на русском языке г-ном Саидахмадом Азимовым, руководителем программ, отдел Поддержки МСП для предпринимательства, Женева, в сотрудничестве с Представительством ВОИС в Российской Федерации
Нет результатов, уточните запрос

30.04.2022
Apple запатентовала "шпионскую" технологию
Компания Apple запатентовала технологию скрытого просмотра содержимого с экрана устройства.
Как было отмечено компанией Patently Apple, патент, который фокусируется на создании различных профилей FaceID для различных нарушений зрения, исследует новый тип экрана конфиденциальности. В патенте не указывается ни один продукт Apple по названию. Вместо этого он относится к электронным устройствам в целом, включая смартфоны, часы, ноутбуки, телевизоры и автомобильные дисплеи.
Рисунки в патенте показывают функцию, работающую на устройстве, похожем на смартфон. Технология будет использовать сканирование лица, чтобы определить, носит ли пользователь требуемые очки.
Рисунки в патенте показывают функцию, работающую на устройстве, похожем на смартфон. Технология будет использовать сканирование лица, чтобы определить, носит ли пользователь требуемые очки.
Нет результатов, уточните запрос

30.04.2022
ФМБА запатентовало спрей для носа от COVID-19
По словам главы агентства Вероники Скворцовой, препарат не влияет на человеческий геном и иммунитет, но при этом высокоэффективно «выключает» копирование вируса. Институт иммунологии, входящий в структуру Федерального медико-биологического агентства (ФМБА), получил патент на комбинированное лекарственное средство против коронавируса. Об этом сообщает пресс-служба ФМБА.
Препарат МИР-19 (расшифровывается как «Малая интерферирующая РНК») предназначен для профилактики и лечения COVID-19 и представляет собой спрей для носа или жидкость для ингаляций.
Статья, посвященная российской разработке, вышла 10 апреля в научном журнале Европейской академии аллергологии и клинической иммунологии (EAACI) Allergy.
Руководитель ФМБА Вероника Скворцова назвала МИР-19 уникальным препаратом. «Он безопасен для человека, не влияет на человеческий геном и иммунитет, но при этом высокоэффективно «выключает» копирование вируса и предотвращает самые тяжелые формы развития коронавирусной инфекции», — пояснила она.
ПодробнееПрепарат МИР-19 (расшифровывается как «Малая интерферирующая РНК») предназначен для профилактики и лечения COVID-19 и представляет собой спрей для носа или жидкость для ингаляций.
Статья, посвященная российской разработке, вышла 10 апреля в научном журнале Европейской академии аллергологии и клинической иммунологии (EAACI) Allergy.
Руководитель ФМБА Вероника Скворцова назвала МИР-19 уникальным препаратом. «Он безопасен для человека, не влияет на человеческий геном и иммунитет, но при этом высокоэффективно «выключает» копирование вируса и предотвращает самые тяжелые формы развития коронавирусной инфекции», — пояснила она.

30.04.2022
В России спроектировали стратолет для путешествий между континентами
Ученые Казанского национального исследовательского технического университета имени Туполева (КАИ) спроектировали сверхзвуковой летательный аппарат для межконтинентальных полетов в стратосфере, следует из документа, опубликованного на сайте Роспатента.
Стратолет будет состоять из фюзеляжа с крыльями, горизонтальных управляющих поверхностей спереди и сзади, комбинированного ракетного или воздушно-ракетного двигателя на кислороде и разгонного блока, к которому закрепят два газотурбинных двигателя и обтекатель двигателя фюзеляжа. У блока будет овальное крыло, прикрепленное через два топливных бака к концам крыльев стратолета.
Как отмечают разработчики, предложенными ими технические решения позволят создать машину, которая будет отличаться от зарубежных конкурентов увеличенной полезной нагрузкой и уменьшенным временем взлета. Наиболее близким иностранным аналогом перспективного аппарата они назвали проект британского многоразового беспилотного космолета Skylon компании Reaction Engines Limited, который планируется поднять в воздух в середине 2020-х годов.
Стратолет будет состоять из фюзеляжа с крыльями, горизонтальных управляющих поверхностей спереди и сзади, комбинированного ракетного или воздушно-ракетного двигателя на кислороде и разгонного блока, к которому закрепят два газотурбинных двигателя и обтекатель двигателя фюзеляжа. У блока будет овальное крыло, прикрепленное через два топливных бака к концам крыльев стратолета.
Как отмечают разработчики, предложенными ими технические решения позволят создать машину, которая будет отличаться от зарубежных конкурентов увеличенной полезной нагрузкой и уменьшенным временем взлета. Наиболее близким иностранным аналогом перспективного аппарата они назвали проект британского многоразового беспилотного космолета Skylon компании Reaction Engines Limited, который планируется поднять в воздух в середине 2020-х годов.

30.04.2022
Ученые нашли способ защитить сталь от враждебной среды
Агрессивная среда, например, морская вода и трение, со временем разрушает даже очень прочные изделия из нержавеющей стали. Способ защиты стальных поверхностей предложили ученые НИТУ "МИСиС" совместно с коллегами из Чехии. Авторы разработки считают, что их новое покрытие может существенно повысить защиту морской и прибрежной инфраструктуры, а также снизить риск возникновения аварий и поломок оборудования. Исследование опубликовано в журнале Wear.

30.04.2022
Ядерный центр "Росатома" создаст снаряд для ловли дронов режущей сетью
Ученые российского федерального ядерного центра — Всероссийского научно-исследовательского института технической физики (РФЯЦ-ВНИИТФ, Снежинск Челябинской области) создают новый боеприпас, предназначенный для более эффективной борьбы с малоразмерными беспилотниками и авиабомбами, следует из документа, размещенного на сайте Роспатента.
Согласно описанию изобретения, этот снаряд был запатентован в конце октября 2021 года. Сейчас специалисты РФЯЦ готовятся к изготовлению и предварительным испытаниям этого изделия.
Планируется, что снаряд сможет бороться с малоразмерными беспилотниками или управляемыми авиабомбами противника успешнее существующих образцов за счет повышения площади эффективного поражения дронов.
Согласно описанию изобретения, этот снаряд был запатентован в конце октября 2021 года. Сейчас специалисты РФЯЦ готовятся к изготовлению и предварительным испытаниям этого изделия.
Планируется, что снаряд сможет бороться с малоразмерными беспилотниками или управляемыми авиабомбами противника успешнее существующих образцов за счет повышения площади эффективного поражения дронов.
Нет результатов, уточните запрос

16.05.2022
Изобретатели показали новые строительные и военные разработки.
Новый материал создали в «Наноматериалы и Нанотехнологии» Московского государственного строительного университета (МГСУ - бывший МИСИ)
"В бетоне снижена плотность. Внутри материала — полости, заполненные газом. За счет этого он такой легкий. Бетон очень прочный, его можно использовать при строительстве многоэтажных домов, Эта разработка поможет снизить затраты при строительстве многоэтажек, так как высокопрочный легкий бетон дешевле."сообщил один из авторов , научный сотрудник центра Александр Иноземцев. (это интересно такие разработки ранее велись с добавками графена, но он очень дорог -прим.автора).
Также в МГСУ придумали, что делать с борщевиком . Студентка магистратуры Элина Горбунова представила экологичные отделочные материалы из стебля сухого растения, смешав его с гипсом, цементом (идея в общем - то не нова, новое только то, что там борщевик, а не другие растения, был даже и есть бетон с растительным наполнителем - арболит прим.автора).
Студенты из Московского авиационного института показали мобильно-пилотажный комплекс. Это небольшой аппарат с креслом, педалями, рычагом и монитором. — Наш аппарат предназначен для отработки навыков пилотирования и управления беспилотниками, — объясняет студент Иван Антонов (педали и рычаги это круто, но не ново. Однако актуально в сегодняшней ситуации -прим.автора).
Представили свои изобретения и школьники. Среди них десятилетний Михаил Кирильчук из школы № 1569. Дома Михаил распечатал машинку на 3D-принтере, прикрепил на нее дальномер и запрограммировал его так, что та разворачивается при виде препятствия на 90 градусов "Пока устройство не видит ямы, я планирую его доработать" — рассказал Михаил Кирильчук. (не будем строги к школьнику -вырастит пойдет в Яндекс, если тот еще останется -прим.автора).

04.05.2022
Японцы изобрели миниробот-"бакуган" для Луны
Другие публикации канала
Как удаленно подать заявку и получить российский патент, сэкономив на госпошинах 30% и более процентов. Система АРМ Регистратор
Обучающий бесплатный семинар «Патентуем правильно»
Есть ли смысл начинать переходить на Linux-системы с Windows в связи с санкциями на интеллектуальную собственность?
Японцы изобрели миниробот-"бакуган" для Луны
7 мая
робот-луноход
Агентство аэрокосмических исследований (JAXA) отправит на Луну новою разработку робота-трансформера.Устройство имеет сферическую форму, а затем превратится в подобие «Бакугана» (японская игрушка-трансформер), способного бодро перемещаться по рыхлому лунному грунту.
Бакуган до трансформации имеет округлую форму и диаметр 80 мм и малый вес - все лишь 250 г. Японцы (компания под брендом Ispace) планируют отправить Бакуганf на Луну в 2022 году.
В создании робота учавствовали также JAXA и Toyota, Sony, компания TOMY и Университет Дошиша.
В 2020 году Япония пресоединилась к странам (всего семь стран), которые подписали с НАСА «Artemis Accords» (Соглашения Артемиды) по мирному освоению Луны.
В начале 2021 года НАСА и правительство Японии подписали соглашение о строительстве орбитальной лунной станции Lunar Gateway в рамках программы «Artemis Accords».
Кроме того, JAXA работат над модулем жизнеобеспечения I-Habс системой экологического контроля и жизнеобеспечения I-Hab, аккумуляторы и терморегулятор,разработанные Европейским космическим агентством (ESA) до его запуска. Данные компоненты важны для непрерывной работы модуля как с экипажем, так и в автономном режиме.

03.05.2022
Молодой изобретатель, сделал протез руки из конструтора LEGO
Дэвид Агилар Амфу родился с патологией, которая препятствовалв развитию его правой руки и грудной мышцы. 22-летний изобретатель попал в книгу рекордов Гиннеса за то, что стал первым человеком, самостоятельно построившим свой собственный полностью функционирующий протез руки с конструктора LEGO.
ПодробнееДэвид видит свою миссию в том, чтобы сделать доступное протезирование широко доступным и повысить осведомленность о различных способностях, работая, чтобы помочь другим молодым людям поверить, что “мечты возможны, если вы боретесь за них”.
Инновационный путь Дэвида начался в возрасте пяти лет, когда он получил свой первый набор кирпичиков LEGO. Он часами играл и они были любимой игрушкой.
В девять лет, решив не определяться и не ограничиваться своим состоянием, он начал изучать, как построить механическую руку из кирпичей LEGO.
Девять лет спустя, в 18 лет, ему удалось построить свою собственную протезную руку, используя кирпичи LEGO. Он пришел с подвижным локтевым суставом и граббером, чтобы поднять вещи. Он продолжал совершенствовать свой протез и теперь имеет коллекцию из пяти различных моделей, сделанных из кирпичей LEGO.
Инновационный путь Дэвида начался в возрасте пяти лет, когда он получил свой первый набор кирпичиков LEGO. Он часами играл и они были любимой игрушкой.
В девять лет, решив не определяться и не ограничиваться своим состоянием, он начал изучать, как построить механическую руку из кирпичей LEGO.
Девять лет спустя, в 18 лет, ему удалось построить свою собственную протезную руку, используя кирпичи LEGO. Он пришел с подвижным локтевым суставом и граббером, чтобы поднять вещи. Он продолжал совершенствовать свой протез и теперь имеет коллекцию из пяти различных моделей, сделанных из кирпичей LEGO.

02.05.2022
ФИПС Роспатента уже совершенствует интерфейс и устраняет баги своего нового патентного поисковика.
Напомним,tm@rinevis.ru что для ФИПС Роспатента открытие бесплатного поиска это действительно достижения.
В ФИПС поиск всегда был неудобным, платным и с необходимостью обязательной регистрации, в то время как в большинстве патентных ведомств с
Возможно решение о предоставлении бесплатного поиска вызвано критикой и развитием патентных поисковых сервисов от Яндекс и Гугл.
Мы уже протестировали сервис ФИПС "Цифровая Поисковая Платформа" и можем отметить, что в целом поиск очень даже не плохой. Из недостатков - невозможность отложить все найденные патенты и неудобное скачивание найденных патентов. Но это не критично, надеюсь эти и другие недостатки разработчики скоро устранят. Большим плюсом является возможность поиска по странам СНГ и постсоветсткого пространства, что ранее было доступно только в платной базе Евразийского патентного ведомства.
Ссылки на сервис ФИПС "Цифровая Поисковая Платформа" и другие рабочие патентные поисковики Вы можете найти на нашем сайте https://iqin.ru/masters
Нет результатов, уточните запрос

15.03.2022
Революционизирующие квантовые схемы: точное проектирование с использованием графена
Ученые из CiQUS, ICN2, Университета Кантабрии, DIPC и DTU объединяют усилия для разработки универсального метода построения углеродных наноцепей по кирпичикам с настраиваемыми свойствами.
Возможные области применения включают будущие электронные устройства, схемы для квантовых компьютеров и термоэлектрические наноматериалы для возобновляемых источников энергии.
Представьте, что у вас есть здание, сделанное из штабелей кирпичей, соединенных адаптируемыми мостами. Вы нажимаете на ручку, которая изменяет мосты, и здание меняет функциональность. Разве это не было бы здорово?
Команда исследователей во главе с проф. Айтор Мугарза из Каталонского института нанонауки и нанотехнологий (ICN2) и ICREA вместе с профессором Дж. Диего Пенья из Центра исследований в области биологической химии и молекулярных материалов Университета Сантьяго-де-Кампостела (CiQUS-USC), д-р Сезар Морено, бывший член команды ICN2, а в настоящее время научный сотрудник Университета Кантабрии, и д-р Аран Гарсия-Лекуэ из Международного физического центра Доностиа (DIPC) и Фонда Икербаску, сделали нечто аналогичное, но в масштабе одного атома, с целью синтеза нового углерода -материалы на основе с настраиваемыми свойствами.
Как объясняется в статье, только что опубликованной в Журнале Американского химического общества (JACS) и размещенной на обложке номера, это исследование является значительным прорывом в точном проектировании атомно-тонких материалов, называемых “2D материалами” из-за их уменьшенной размерности. Предлагаемая технология изготовления открывает захватывающие новые возможности для материаловедения и, в частности, для применения в передовой электронике и будущих решениях для устойчивой энергетики.
JACS апрель 2023
Результаты исследования были опубликованы на обложке журнала Американского химического общества (JACS). Авторы: доктор Мария Тенорио и Дамасо Торрес · ICN2
Авторы этого исследования синтезировали новую нанопористую графеновую структуру, соединив ультраузкие графеновые полоски, известные как “нановолокна”, с помощью гибких “мостиков”, изготовленных из фениленовых фрагментов (которые являются частями более крупных молекул). Постоянно изменяя архитектуру и угол наклона этих мостов, ученые могут контролировать квантовую связь между каналами из нановолокон и, в конечном счете, точно настраивать электронные свойства графеновой наноархитектуры. Возможность настройки также может контролироваться внешними стимулами, такими как напряжение или электрические поля, что открывает возможности для различных применений.
Эти новаторские результаты, полученные в результате сотрудничества между ведущими испанскими институтами (CiQUS, ICN2, Университет Кантабрии, DIPC) и Техническим университетом Дании (DTU), показывают, что предложенная стратегия молекулярных мостов может оказать большое влияние на синтез новых материалов с индивидуальными свойствами и является мощным инструментом для реализации квантовых схем. Они выполняют операции, аналогичные операциям обычных схем, хотя в отличие от последних, квантовые схемы используют квантовые эффекты и явления. Проектирование и реализация этих систем чрезвычайно важны для разработки квантовых компьютеров.
Но потенциальные применения подхода, предложенного в этом исследовании, выходят за рамки будущих электронных устройств и компьютеров. Фактически, это также может привести к разработке термоэлектрических наноматериалов, которые могут оказать важное влияние на производство возобновляемой энергии и утилизацию отработанного тепла, тем самым решая еще одну важную социальную проблему.
Ссылка: “Разработка молекулярных мостов для настройки квантового электронного транспорта и анизотропии в нанопористом графене” Сесара Морено, Ксабье Диаса де Керио, Мануэля Вилас-Варелы, Марии Тенорио, Ане Сарасолы, Мадса Брэндбиге, Диего Пенья, Арана Гарсия-Лекуэ и Айтора Мугарзы, 29 марта 2023, Журнал Американского химического общества.
DOI: 10.1021 / jacs.3c00173
Возможные области применения включают будущие электронные устройства, схемы для квантовых компьютеров и термоэлектрические наноматериалы для возобновляемых источников энергии.
Представьте, что у вас есть здание, сделанное из штабелей кирпичей, соединенных адаптируемыми мостами. Вы нажимаете на ручку, которая изменяет мосты, и здание меняет функциональность. Разве это не было бы здорово?
Команда исследователей во главе с проф. Айтор Мугарза из Каталонского института нанонауки и нанотехнологий (ICN2) и ICREA вместе с профессором Дж. Диего Пенья из Центра исследований в области биологической химии и молекулярных материалов Университета Сантьяго-де-Кампостела (CiQUS-USC), д-р Сезар Морено, бывший член команды ICN2, а в настоящее время научный сотрудник Университета Кантабрии, и д-р Аран Гарсия-Лекуэ из Международного физического центра Доностиа (DIPC) и Фонда Икербаску, сделали нечто аналогичное, но в масштабе одного атома, с целью синтеза нового углерода -материалы на основе с настраиваемыми свойствами.
Как объясняется в статье, только что опубликованной в Журнале Американского химического общества (JACS) и размещенной на обложке номера, это исследование является значительным прорывом в точном проектировании атомно-тонких материалов, называемых “2D материалами” из-за их уменьшенной размерности. Предлагаемая технология изготовления открывает захватывающие новые возможности для материаловедения и, в частности, для применения в передовой электронике и будущих решениях для устойчивой энергетики.
JACS апрель 2023
Результаты исследования были опубликованы на обложке журнала Американского химического общества (JACS). Авторы: доктор Мария Тенорио и Дамасо Торрес · ICN2
Авторы этого исследования синтезировали новую нанопористую графеновую структуру, соединив ультраузкие графеновые полоски, известные как “нановолокна”, с помощью гибких “мостиков”, изготовленных из фениленовых фрагментов (которые являются частями более крупных молекул). Постоянно изменяя архитектуру и угол наклона этих мостов, ученые могут контролировать квантовую связь между каналами из нановолокон и, в конечном счете, точно настраивать электронные свойства графеновой наноархитектуры. Возможность настройки также может контролироваться внешними стимулами, такими как напряжение или электрические поля, что открывает возможности для различных применений.
Эти новаторские результаты, полученные в результате сотрудничества между ведущими испанскими институтами (CiQUS, ICN2, Университет Кантабрии, DIPC) и Техническим университетом Дании (DTU), показывают, что предложенная стратегия молекулярных мостов может оказать большое влияние на синтез новых материалов с индивидуальными свойствами и является мощным инструментом для реализации квантовых схем. Они выполняют операции, аналогичные операциям обычных схем, хотя в отличие от последних, квантовые схемы используют квантовые эффекты и явления. Проектирование и реализация этих систем чрезвычайно важны для разработки квантовых компьютеров.
Но потенциальные применения подхода, предложенного в этом исследовании, выходят за рамки будущих электронных устройств и компьютеров. Фактически, это также может привести к разработке термоэлектрических наноматериалов, которые могут оказать важное влияние на производство возобновляемой энергии и утилизацию отработанного тепла, тем самым решая еще одну важную социальную проблему.
Ссылка: “Разработка молекулярных мостов для настройки квантового электронного транспорта и анизотропии в нанопористом графене” Сесара Морено, Ксабье Диаса де Керио, Мануэля Вилас-Варелы, Марии Тенорио, Ане Сарасолы, Мадса Брэндбиге, Диего Пенья, Арана Гарсия-Лекуэ и Айтора Мугарзы, 29 марта 2023, Журнал Американского химического общества.
DOI: 10.1021 / jacs.3c00173
Нет результатов, уточните запрос
28.04.2022
Роспатент открыл бесплатный поиск по патентам и научно-технической литературе на новой цифровой платформе
Не так давно, мы критиковали в своей статье Патентное Ведомство РФ за то, что оно не имело полноценных сервисов для открытого бесплатного поиска по патентам и товарным знакам, как это уже давно было сделано в патентных ведомствах большинства стран мира, хотя они анонсировались с 2018 года
Однако, 29 марта 2022 мы были приятно удивлены - открылась новая цифровая поисковая платформа Роспатента, которая включает в себя
1. Поиск сведений по мировому фонду изобретений и полезных моделей, включая российские массивы и массивы стран СНГ.
2. Многоязычный полнотекстовый и атрибутивный поиск на основных европейских языках
3. Поиск на основе патентных классификаторов
4. Поиск с использованием искусственного интеллекта
5. Поиск по химическим формулам, генетическим последовательностям и др.
6. Аналитические сервисы, которые позволят проводить мониторинг показателей сферы интеллектуальной собственности.
Для разработчиков реализован программный интерфейс API.
Как, сообщается в анонсе Роспатента работы для обеспечения поиска на цифровой платформе по товарным знакам и по патентам на промышленные образцы находятся в стадии завершения .
Напомним, что ранее поиск по патентам и товарным знакам стоил 60 руб. за один поисковый запрос и имел сложности с регистрацией.
Платформа доступна по ссылке https://searchplatform.rospatent.gov.ru/
Однако, 29 марта 2022 мы были приятно удивлены - открылась новая цифровая поисковая платформа Роспатента, которая включает в себя
1. Поиск сведений по мировому фонду изобретений и полезных моделей, включая российские массивы и массивы стран СНГ.
2. Многоязычный полнотекстовый и атрибутивный поиск на основных европейских языках
3. Поиск на основе патентных классификаторов
4. Поиск с использованием искусственного интеллекта
5. Поиск по химическим формулам, генетическим последовательностям и др.
6. Аналитические сервисы, которые позволят проводить мониторинг показателей сферы интеллектуальной собственности.
Для разработчиков реализован программный интерфейс API.
Как, сообщается в анонсе Роспатента работы для обеспечения поиска на цифровой платформе по товарным знакам и по патентам на промышленные образцы находятся в стадии завершения .
Напомним, что ранее поиск по патентам и товарным знакам стоил 60 руб. за один поисковый запрос и имел сложности с регистрацией.
Платформа доступна по ссылке https://searchplatform.rospatent.gov.ru/
Нет результатов, уточните запрос

26.04.2022
«Цифровая экосистема интеллектуальной собственности» - международная конференция
Роспатентом 28 апреля 2022 года запланировано проведение традиционной Международной конференции по цифровой трансформации «Цифровая экосистема интеллектуальной собственности».
Это площадка, где органы государственной власти, экспертное и бизнес-сообщество обсуждают ключевые вызовы, с которыми сталкиваются государства и основные игроки рынка в результате стремительного развития технологий и их влияния на сферу интеллектуальной собственности.
Будет обсуждаться:
Новые законотворческие инициативы Роспатента;
Актуальные тренды патентования;
Эффективные формы партнёрства в инновациях;
Дизайн знаний и IP-компетенции;
Правовая и регуляторная среда экосистемы интеллектуальной собственности;
Механизмы поддержки коммерциализации и оборота прав;
Цифровые сервисы патентной экосистемы.
Место проведения очных мероприятий конференции: Россия, Москва, Бережковская наб., д.24, стр.1
Записаться на конференцию можно здесь https://rospatent.gov.ru/ru/events/mezhdunarodnaya-konferenciya-rospatenta-15032022
Это площадка, где органы государственной власти, экспертное и бизнес-сообщество обсуждают ключевые вызовы, с которыми сталкиваются государства и основные игроки рынка в результате стремительного развития технологий и их влияния на сферу интеллектуальной собственности.
Будет обсуждаться:
Новые законотворческие инициативы Роспатента;
Актуальные тренды патентования;
Эффективные формы партнёрства в инновациях;
Дизайн знаний и IP-компетенции;
Правовая и регуляторная среда экосистемы интеллектуальной собственности;
Механизмы поддержки коммерциализации и оборота прав;
Цифровые сервисы патентной экосистемы.
Место проведения очных мероприятий конференции: Россия, Москва, Бережковская наб., д.24, стр.1
Записаться на конференцию можно здесь https://rospatent.gov.ru/ru/events/mezhdunarodnaya-konferenciya-rospatenta-15032022

06.04.2022
Новый патент от Sony демонстрирует их новый контролер для нового шлема Playstation VR 2
Хоть нам еще не показали саму гарнитуру PSVR 2, контроллеры для устройства виртуальной реальности уже были представлены. Тем не менее, недавно обнаруженный патент на контроллеры PSVR2 показывает оборудование виртуальной реальности следующего поколения Sony более подробно.
На Портале ВОИС по интеллектуальной собственности (Всемирная организация интеллектуальной собственности) была опубликована новая патентная заявка. Поданный 26 февраля 2021 года и обнародованный 2 декабря 2021 года, он показывает подробные схемы контроллера PSVR 2, расположение кнопок, то, как его будет легче обнаружить с помощью камеры PlayStation Camera.
На Портале ВОИС по интеллектуальной собственности (Всемирная организация интеллектуальной собственности) была опубликована новая патентная заявка. Поданный 26 февраля 2021 года и обнародованный 2 декабря 2021 года, он показывает подробные схемы контроллера PSVR 2, расположение кнопок, то, как его будет легче обнаружить с помощью камеры PlayStation Camera.
Согласно патенту у нового контролера будут схожие адаптивные курки, как и у DUALSENSES.( геймпада от Playstation 5)

05.04.2022
Кафедра ЮНЕСКО и Роспатент проведут "Дни интеллектуальной собственности"
1 апреля 2022 г. Роспатент и Кафедра ЮНЕСКО проведут международную научно-практическую конференцию «Автор в современной экосистеме интеллектуальной собственности». Мероприятие станет продолжением успешно проведенной в 2021 г. конференции «Авторско-правовые проблемы в сфере промышленной собственности».
Планируется, что конференция станет одним ключевых мероприятий «Дней интеллектуальной собственности», которые проводятся в нашей стране по инициативе Кафедры ЮНЕСКО с 2003 г. и приурочены к Международному дню книги и авторского права (23 апреля), провозглашенному ЮНЕСКО, и Международному дню интеллектуальной собственности (26 апреля), провозглашенному Всемирной организацией интеллектуальной собственности (ВОИС).
В нынешнем году ВОИС посвятила свой профессиональный День теме «Интеллектуальная собственность и молодежь: инновации во имя будущего». В свою очередь, ЮНЕСКО на первый план выдвинула тему поддержки чтения: «Благодаря чтению и празднованию Всемирного дня книги и авторского права 23 апреля, мы сможем открыть себя другим, несмотря на расстояния, и путешествовать благодаря воображению. В рамках подготовки к Всемирному дню книги и авторского права ЮНЕСКО призывает вас бросить вызов самому себе, исследовать новые темы, форматы или жанры, которые выходят за рамки обычного. Наша цель - вовлечь людей в чтение и получение удовольствия от этого!».
В нынешнем году ВОИС посвятила свой профессиональный День теме «Интеллектуальная собственность и молодежь: инновации во имя будущего». В свою очередь, ЮНЕСКО на первый план выдвинула тему поддержки чтения: «Благодаря чтению и празднованию Всемирного дня книги и авторского права 23 апреля, мы сможем открыть себя другим, несмотря на расстояния, и путешествовать благодаря воображению. В рамках подготовки к Всемирному дню книги и авторского права ЮНЕСКО призывает вас бросить вызов самому себе, исследовать новые темы, форматы или жанры, которые выходят за рамки обычного. Наша цель - вовлечь людей в чтение и получение удовольствия от этого!».

03.04.2022
В России запретили использовать иностранные программы (софт) в госсекторе и банках
30 марта 2022 года президент РФ Владимир Путин запретил использовать иностранное программное обеспечение государственным органам и госзаказчикам на «значимых объектах критической информационной инфраструктуры».
Запрет ограничен сроком 1 января 2025 года, до этого срока госслужащим придется полностью перейти на софт отечественной разработки.
Также ВВП ввел с 31 марта 2022 Президент ввел запрет на госзакупки без согласования иностранного программного обеспечения для использования на критической инфраструктуре в России.
«С 31 марта заказчики, за исключением организаций с муниципальным участием, осуществляющие закупки <...> не могут осуществлять закупки иностранного программного обеспечения, в том числе в составе программно-аппаратных комплексов в целях его дальнейшего использования на принадлежащих им значимых объектах критической информационной инфраструктуры Российской Федерации», — говорится в указе президента.
Запрет ограничен сроком 1 января 2025 года, до этого срока госслужащим придется полностью перейти на софт отечественной разработки.
Также ВВП ввел с 31 марта 2022 Президент ввел запрет на госзакупки без согласования иностранного программного обеспечения для использования на критической инфраструктуре в России.
«С 31 марта заказчики, за исключением организаций с муниципальным участием, осуществляющие закупки <...> не могут осуществлять закупки иностранного программного обеспечения, в том числе в составе программно-аппаратных комплексов в целях его дальнейшего использования на принадлежащих им значимых объектах критической информационной инфраструктуры Российской Федерации», — говорится в указе президента.

02.04.2022
Роспатент обозначил свою позицию относительно иностранных товарных знаков (брендов)
Как отмечается в публикации на официальном сайте Роспатента, в российских СМИ активно обсуждались темы "отмены" прав на товарные знаки иностранных владельцев из списка недружественных стран.
Роспатент отметил, что в качестве подтверждения данного утверждения приводились ссылки на множество заявок на товарные знаки, поданные в Роспатент на идентичные или сходные с известными брендами знаки. В некоторых таких публикациях содержались утверждения того, что эти знаки уже «одобрены» Роспатентом.
Роспатент по данному поводу сообщил следующее "Вместе с тем, такая публикация говорит лишь о том, что заявка на товарный знак поступила в Роспатент, получила свой порядковый номер и по ней зафиксирована дата поступления.
Стоит отдельно подчеркнуть, что подача заявки на товарный знак в Роспатент, ее прием и присвоение порядкового номера не предусматривает автоматическое предоставление правовой охраны поданному обозначению в качестве товарного знака.
Чтобы обозначение получило правовую охрану, требуется прохождение двух этапов экспертизы ..."
Таким образом Роспатент подтвердил, что экспертиза товарных знаков будет происходить без изменений и "захвата" или "пессимизации" иностранных знаков (брендов) или выдачи сходных знаков типа "Abibos" вместо "Adidas" или "Идея" вместо "Ikea" происходить не будет.
Роспатент отметил, что в качестве подтверждения данного утверждения приводились ссылки на множество заявок на товарные знаки, поданные в Роспатент на идентичные или сходные с известными брендами знаки. В некоторых таких публикациях содержались утверждения того, что эти знаки уже «одобрены» Роспатентом.
Роспатент по данному поводу сообщил следующее "Вместе с тем, такая публикация говорит лишь о том, что заявка на товарный знак поступила в Роспатент, получила свой порядковый номер и по ней зафиксирована дата поступления.
Стоит отдельно подчеркнуть, что подача заявки на товарный знак в Роспатент, ее прием и присвоение порядкового номера не предусматривает автоматическое предоставление правовой охраны поданному обозначению в качестве товарного знака.
Чтобы обозначение получило правовую охрану, требуется прохождение двух этапов экспертизы ..."
Таким образом Роспатент подтвердил, что экспертиза товарных знаков будет происходить без изменений и "захвата" или "пессимизации" иностранных знаков (брендов) или выдачи сходных знаков типа "Abibos" вместо "Adidas" или "Идея" вместо "Ikea" происходить не будет.

01.04.2022
Палата по патентным спорам аннулировала патент, блокирующий продажи корейских смартфонов и систему Samsung Pay
Роспатент аннулировал патент швейцарской компании "Sqwin SA" номер №2686003 на систему электронных платежей в связи с нарушениями при выдаче патента в России в 2019 году, а также из-за отсутствия в нем "новизны" и "изобретательского уровня".
Напомним, что ранее Арбитражный суд Москвы принял решение о запрете ввоза и продажи и предложений к продаже в РФ 61 модели смартфонов компании Samsung, по заявлению компании Sqwin SA, зарегистрированной в Швейцарии на основании патента на изобретение №2686003 - Система электронных платежей» (Международная заявка ).
Данное решение суда, было принято еще до "Операции Z", блокировало ввоз и продажу смартфонов с Samsung Pay и блокировки сервиса платежей компании, а также было бы прецедентом для блокировки Apple Pay и Google Pay в случае аналогичных исков. Напомним, что Apple Pay и Google Pay после известных событий покинули российский рынок
Напомним, что ранее Арбитражный суд Москвы принял решение о запрете ввоза и продажи и предложений к продаже в РФ 61 модели смартфонов компании Samsung, по заявлению компании Sqwin SA, зарегистрированной в Швейцарии на основании патента на изобретение №2686003 - Система электронных платежей» (Международная заявка ).
Данное решение суда, было принято еще до "Операции Z", блокировало ввоз и продажу смартфонов с Samsung Pay и блокировки сервиса платежей компании, а также было бы прецедентом для блокировки Apple Pay и Google Pay в случае аналогичных исков. Напомним, что Apple Pay и Google Pay после известных событий покинули российский рынок
Нет результатов, уточните запрос

30.03.2022
Инженеры из BMW анонсируют технологию изменения цвета кузова путем нажатия одной кнопки
В BMW IX Flow изменение цвета кузова легко можно будет осуществить нажатием одной кнопки.
В настоящее время доступны три цвета: белый, черный и серый. Кузов специально разработан и стимулируется электрическими сигналами для изменения цвета экстерьера автомобиля.
Корпус содержит миллионы микрокапсул диаметром, эквивалентным толщине человеческого волоса, которые содержат отрицательные белые пигменты и положительные черные пигменты.
Технология похожа на электронные дисплеи E-Ink, которые имитируют бумажную печать и часто применяются в электронных книгах.
Стимуляция электрическим полем заставляет белые или черные пигменты накапливаться на поверхности микрокапсулы, придавая кузову желаемый оттенок в любой момент времени.
По словам инженеров изобретателей, технология не только эффектна, но и имеет практическое применение. Например, белая поверхность лучше отражает солнечный свет и может предотвратить салон автомобиля от перегрева. Тёмные же тона, наоборот, помогают сохранять тепло в прохладную погоду.
В настоящее время доступны три цвета: белый, черный и серый. Кузов специально разработан и стимулируется электрическими сигналами для изменения цвета экстерьера автомобиля.
Корпус содержит миллионы микрокапсул диаметром, эквивалентным толщине человеческого волоса, которые содержат отрицательные белые пигменты и положительные черные пигменты.
Технология похожа на электронные дисплеи E-Ink, которые имитируют бумажную печать и часто применяются в электронных книгах.
Стимуляция электрическим полем заставляет белые или черные пигменты накапливаться на поверхности микрокапсулы, придавая кузову желаемый оттенок в любой момент времени.
По словам инженеров изобретателей, технология не только эффектна, но и имеет практическое применение. Например, белая поверхность лучше отражает солнечный свет и может предотвратить салон автомобиля от перегрева. Тёмные же тона, наоборот, помогают сохранять тепло в прохладную погоду.

30.03.2022
Патент на систему борьбы с мошенническими звонками, использующими интеллектуальных ботов
Опубликован патент на систему противодействия нежелательным мошенническим и спам звонкам, в которых используется искусственная речь, синтезируемая компьютерными программами, маскирующими под людей (ссылка на патент внизу публикации).
В настоящий момент практически любой обладатель универсального мобильного устройства (например, мобильного телефона, смартфона, планшета и т.д.) сталкивается с нежелательными звонками, SMS–сообщениями, электронными письмами из банков, медицинских центров, страховых фирм, салонов красоты и других компаний, использующих в своей работе телемаркетинг.
Большинство из этих компаний неявно прописывают распространение рекламы через коммуникационные сети в договоре и тем самым обходят правовые нормы.
Компании, предоставляющие услуги телемаркетинга, активно используют интеллектуальных ботов, которые имитируют в процессе общения людей.
Роботы определяют уровень раздражительности и зачастую специально выстраивают разговор так, чтобы маскировать искусственное происхождение беседы.
В настоящий момент практически любой обладатель универсального мобильного устройства (например, мобильного телефона, смартфона, планшета и т.д.) сталкивается с нежелательными звонками, SMS–сообщениями, электронными письмами из банков, медицинских центров, страховых фирм, салонов красоты и других компаний, использующих в своей работе телемаркетинг.
Большинство из этих компаний неявно прописывают распространение рекламы через коммуникационные сети в договоре и тем самым обходят правовые нормы.
Компании, предоставляющие услуги телемаркетинга, активно используют интеллектуальных ботов, которые имитируют в процессе общения людей.
Роботы определяют уровень раздражительности и зачастую специально выстраивают разговор так, чтобы маскировать искусственное происхождение беседы.

30.03.2022
В Санкт-Петербурге пройдет Международный форум «Дни интеллектуальной собственности»
В Санкт-Петербурге пройдет Международный форум «Дни интеллектуальной собственности» посвященный патентам и товарным знакам и авторским правам.Подробное расписание смотрите на нашем Дзене по ссылке в "Подробнее"

30.03.2022
Патентное ведомство США отказалась сотрудничать с российским патентным ведоством (Роспатентом)
Госдепартамент США, дал указание Патентному ведомству США (USPTO) прекратить любое взаимодействие с должностными лицами Роспатента, Евразийской патентной организацией, а также с патентным ведоством Беларуси. Соответствующее заявление опубликовано на официальном сайте USPTO. (Перевод можно посмотреть здесь)
Напомним, что ранее о завершении взаимодействия с патентными ведомствами России, Беларусии и Евразийским патентным ведомством заявило Европейское патентное ведомство (ЕПВ). См. публикацию по ссылке.
Комментируя вышеизложенное, Роспатент на своем официальном сайте заявляет, что от ЕПВ не поступала информация о том, какие конкретно совместные проекты будут приостановлены, а сообщение USPTO содержит данные исключительно о прерывании контактов между отдельными сотрудниками.
Таким образом, по мнению Роспатента, отсутствуют основания предполагать введение ограничений на прием и рассмотрение заявок на патенты и товарные от российских заявителей.
Роспатент выразил искреннюю надежду на конструктивный диалог взаимодействия с западными коллегами: «система интеллектуальной собственности была и остается созидательным механизмом, благодаря которому воплощаются в жизнь инновационные научные идеи и творческие достижения».
Напомним, что ранее о завершении взаимодействия с патентными ведомствами России, Беларусии и Евразийским патентным ведомством заявило Европейское патентное ведомство (ЕПВ). См. публикацию по ссылке.
Комментируя вышеизложенное, Роспатент на своем официальном сайте заявляет, что от ЕПВ не поступала информация о том, какие конкретно совместные проекты будут приостановлены, а сообщение USPTO содержит данные исключительно о прерывании контактов между отдельными сотрудниками.
Таким образом, по мнению Роспатента, отсутствуют основания предполагать введение ограничений на прием и рассмотрение заявок на патенты и товарные от российских заявителей.
Роспатент выразил искреннюю надежду на конструктивный диалог взаимодействия с западными коллегами: «система интеллектуальной собственности была и остается созидательным механизмом, благодаря которому воплощаются в жизнь инновационные научные идеи и творческие достижения».
30.03.2022
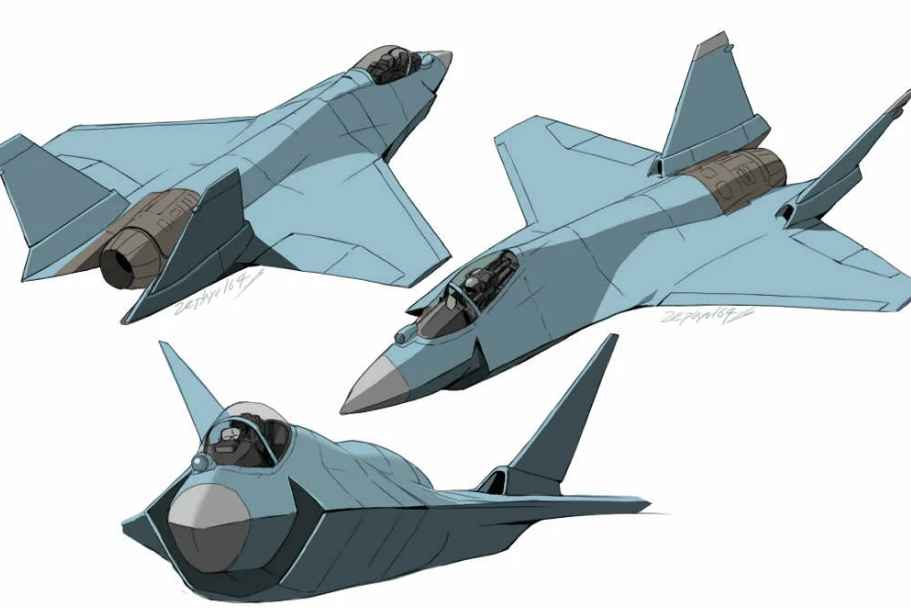
Опубликован патент на лёгкий тактический истребитель Т-75 "Checkmate"
На сайте ФИПС Роспатента опубликован в открытом доступе патент на истребитель Т-75 под брендом "Checkmate" (перевод с английского "Шах и Мат") . Не можем не отметить звучное название бренда самолета (Чекмэйт), которое наполнено соответствующей смысловой нагрузкой.
С оригинальной публикацией всех материалов патента на сайте ФИПС Роспатента можно ознакомится по ссылке внизу статьи.
В качестве владельца патента указано Акционерное общество "Авиационная холдинговая компания "Сухой" (АО "Компания "Сухой")
Формула изобретения, определяющая объем правовой охраны довольно лаконичная и описывает внешнюю компоновку и управление самолетом, не выдавая секретов его внутреннего устройства:
1. Легкий тактический самолет, содержащий фюзеляж с боковыми хвостовыми балками, консоли крыла, хвостовое оперение, воздухозаборник, силовую установку и поворотное реактивное сопло, отличающийся тем, что боковые хвостовые балки являются развитыми и заканчиваются поворотными на горизонтальной оси частями, на консолях крыльев, имеющих большую стреловидность, располагаются поворотные носки и внутренние и внешние элевоны, а хвостовое оперение выполнено V-образным, консоли которого выполнены цельноповоротными, выполняющими функцию как горизонтального, так и вертикального оперения, причем воздухозаборник располагается в нижней части фюзеляжа и частично его охватывает с нижней стороны.
2. Легкий тактический самолет по п.1, отличающийся тем, что поворотное реактивное сопло располагается по оси симметрии фюзеляжа и используется для управления и балансировки в полете и выполнено отклоняемым в вертикальной плоскости.
3. Легкий тактический самолет по п.1, отличающийся тем, что поворотное реактивное сопло располагается по оси симметрии фюзеляжа и используется для управления и балансировки в полете и выполнено всеракурсным.
4. Легкий тактический самолет по п.1, отличающийся тем, что ось поворота консолей V-образного хвостового оперения расположена перпендикулярно оси фюзеляжа.
5. Легкий тактический самолет по п.4, отличающийся тем, что ось поворота консолей V-образного хвостового оперения располагается ближе к передней кромке консолей.
6. Легкий тактический самолет по п.1, отличающийся тем, что все кромки воздухозаборника выполнены стреловидными.
Истребитель создается с открытой архитектурой, по проекту создателей будет иметь передовую бортовую электронику, в том числе РЛС с АФАР и систему РЭБ нового поколения, система круговой оптической и радиотехнической разведки, встроенная система радиоэлектронных помех, оптическая прицельная система, система широкодиапазонной связи.
В конструкцию самолета изначально заложена возможность создания на одной базе целого семейства , в том числе беспилотных летательных аппаратов. Таким образом самолет изначально создается в виде "открытой платформы", с возможностью адаптации под различные задачи.
С оригинальной публикацией всех материалов патента на сайте ФИПС Роспатента можно ознакомится по ссылке внизу статьи.
В качестве владельца патента указано Акционерное общество "Авиационная холдинговая компания "Сухой" (АО "Компания "Сухой")
Формула изобретения, определяющая объем правовой охраны довольно лаконичная и описывает внешнюю компоновку и управление самолетом, не выдавая секретов его внутреннего устройства:
1. Легкий тактический самолет, содержащий фюзеляж с боковыми хвостовыми балками, консоли крыла, хвостовое оперение, воздухозаборник, силовую установку и поворотное реактивное сопло, отличающийся тем, что боковые хвостовые балки являются развитыми и заканчиваются поворотными на горизонтальной оси частями, на консолях крыльев, имеющих большую стреловидность, располагаются поворотные носки и внутренние и внешние элевоны, а хвостовое оперение выполнено V-образным, консоли которого выполнены цельноповоротными, выполняющими функцию как горизонтального, так и вертикального оперения, причем воздухозаборник располагается в нижней части фюзеляжа и частично его охватывает с нижней стороны.
2. Легкий тактический самолет по п.1, отличающийся тем, что поворотное реактивное сопло располагается по оси симметрии фюзеляжа и используется для управления и балансировки в полете и выполнено отклоняемым в вертикальной плоскости.
3. Легкий тактический самолет по п.1, отличающийся тем, что поворотное реактивное сопло располагается по оси симметрии фюзеляжа и используется для управления и балансировки в полете и выполнено всеракурсным.
4. Легкий тактический самолет по п.1, отличающийся тем, что ось поворота консолей V-образного хвостового оперения расположена перпендикулярно оси фюзеляжа.
5. Легкий тактический самолет по п.4, отличающийся тем, что ось поворота консолей V-образного хвостового оперения располагается ближе к передней кромке консолей.
6. Легкий тактический самолет по п.1, отличающийся тем, что все кромки воздухозаборника выполнены стреловидными.
Истребитель создается с открытой архитектурой, по проекту создателей будет иметь передовую бортовую электронику, в том числе РЛС с АФАР и систему РЭБ нового поколения, система круговой оптической и радиотехнической разведки, встроенная система радиоэлектронных помех, оптическая прицельная система, система широкодиапазонной связи.
В конструкцию самолета изначально заложена возможность создания на одной базе целого семейства , в том числе беспилотных летательных аппаратов. Таким образом самолет изначально создается в виде "открытой платформы", с возможностью адаптации под различные задачи.
Нет результатов, уточните запрос

18.03.2022
Как защитить свой бренд во ВКонтакте от копирования?
Современный бизнес сложно представить без страниц в социальных сетях, а иногда такие странички являются для предпринимателя единственным каналом поиска клиентов. Сегодня российская социальная сеть ВКонтакте столкнулась с наплывом новых пользователей, среди которых немало бизнесменов. Однако, далеко не каждый предприниматель задумывается о защите своего бренда, прежде чем запустить рекламу в соцсети или начать продавать товар, а зря. Это чревато не самыми приятными последствиями. Даже будучи добросовестным предпринимателем, есть риск перейти дорогу правообладателю и выплатить ему по решению суда крупную компенсацию.
Мы подобрали несколько кейсов, которые помогут вам понять, почему так важно заранее регистрировать товарный знак.
200 тысяч рублей за упоминание чужого бренда в посте
Фитнес-школа «Анатомия: фитнес аутсорсинг» разместила на своей страничке ВКонтакте рекламный пост, в котором упомянул сочетание «ALEX FITNESS». Однако, словесное обозначение «ALEX FITNESS» является элементом товарного знака и принадлежит известной российской сети фитнес-клубов «Алекс Фитнес». Правообладатель обратился в суд и за такое необдуманное содержание рекламного поста ответчику пришлось выплатить компенсацию правообладателю, которая составила 200 000 рублей (дело №А56-74047/2018).
1 млн рублей за использование чужих товарных знаков в Интернете
Фитнес-школа «Анатомия: фитнес аутсорсинг» разместила на своей страничке ВКонтакте рекламный пост, в котором упомянул сочетание «ALEX FITNESS». Однако, словесное обозначение «ALEX FITNESS» является элементом товарного знака и принадлежит известной российской сети фитнес-клубов «Алекс Фитнес». Правообладатель обратился в суд и за такое необдуманное содержание рекламного поста ответчику пришлось выплатить компенсацию правообладателю, которая составила 200 000 рублей (дело №А56-74047/2018).
1 млн рублей за использование чужих товарных знаков в Интернете

17.03.2022
Российские адвокаты подадут коллективный иск против Apple
По сообщению агентства ТАСС, представители адвокатского бюро «Чернышов, Лукоянов и партнеры» (CLP) подадут иск к компании Apple в связи с прекращением работы платежного сервиса Apple Pay на устройствах.
Старший партнер коллегии Константин Лукоянов рассказал агентству, что юридическая фирма решила подать в суд на Apple, поскольку права российских потребителей были нарушены «необоснованным» и «односторонним» отключением Apple Pay.
По мнению адвоката, данный шаг компании необходимо рассматривать как «умышленный моральный ущерб» российским пользователям и владельцам устройств Apple. Размер компенсации не указывается, но в иске отмечается, что он должен быть «существенным».
Отметим, что ранее эта же группа адвокатов подала групповой иск к Netflix на 60 млн рублей из-за решения сервиса приостановить работу в России.
Также петербуржец Сергей Панфиленко направил в Московский районный суд города Санкт-Петербург иск к Sony, с требованием разблокировать Playstation Store на территории РФ.

16.03.2022
Китайская Great Wall запатентовала в России рамный внедорожник Tank 700
Китайская компания Great Wall Motors оформила в России патентные документы на внешний вид внедорожника Tank 700. Его прототип впервые представили в апреле 2021 года на международном автосалоне в Чэнду, где автомобиль дебютировал как концепт-кар.
Tank 700 имеет рамную конструкцию с независимой передней пружинной подвеской. Концепт внедорожника оснащён трёхлитровым турбированным двигателем V6 мощностью 354 л.с. (500 Нм) и девятиступенчатым «автоматом». О моторной гамме серийной модели информации пока нет.
В Китае Tank 400 начнут производить и продавать в течение 2022 года, когда модель доберется до России пока не известно.
Сегодня модельная линейка Great Wall в России представлена пикапами Wingle 7 и Poer. Кроме того, на отечественном рынке присутствует дочерний бренд под названием Haval, имеющий собственное предприятие в Тульской области.

15.03.2022
Патент на самолёт с бортовой лазерной системой
АНТК им. Бериева патентовало промобразцами несколько моделей подобных самолетов начиная с 2004 (см. изображения выше)
Патентом на промышленный образец охраняется только внешний вид (дизайн) изделия без раскрытия его устройства и технических характеристик.
В патентах явно просматриваются наработки, созданного в СССР самолёта–носителя лазерного оружия Ил-76МД.
Напомним, что ранее бывший директор ТАНТК имени Бериева обвинялся в афере с патентом №53135 на самолет-амфибию, за то, что необоснованно включил себя в состав авторов патента, подав ходатайство в ФИПС Роспатента, хотя в момент подачи патента он даже не работал на заводе.
После чего "изобретатель" издал пять приказов о вознаграждении за использование патента и получил 3,7 миллиона рублей.
Такая схема является стандартной и самой простой в практики афер с интеллектуальной собственностью.
После чего "изобретатель" издал пять приказов о вознаграждении за использование патента и получил 3,7 миллиона рублей.
Такая схема является стандартной и самой простой в практики афер с интеллектуальной собственностью.

14.03.2022
Возобновляемая энергия
Мобильная арктическая ветроэлектростанция
Патент: 2769560
Авторы: Александр Бердников, Сергей Куканков
Патентообладатель: Федеральное государственное казенное образовательное учреждение высшего образования "Московский пограничный институт Федеральной службы безопасности Российской Федерации"
Мобильная ветроэлектростанция предназначена для использования в условиях Арктического региона, где именно ветер, вне зависимости от времени суток и года, является наиболее эффективным источником энергии. Высоту и площадь лопастей в конструкции можно регулировать в зависимости от силы и высоты воздушных потоков. Тем самым обеспечивается возможность использования электростанции в отдаленных, мало изученных областях Крайнего Севера в широком диапазоне сил и направления ветра.
Использование экологически чистых источников получения энергии решит как проблему обеспечения электроэнергией, так и вопрос сохранения природы в этом регионе. Кроме того, использование магнитных подшипников в конструкции позволит повысить эффективность преобразования энергии ветра, так как уменьшатся потери от трения (смазочные материалы в условиях низких температур будут не нужны).
Арктика имеет стратегическое значение для России. Ввиду суровых климатических условий обширное пространство к северу от полярного круга осталось слабо изученным и мало освоенным, а расположенные там сырьевые запасы нетронуты и огромны. Также Арктика рассматривается как альтернативный путь перевозки грузов. Разработки российских изобретателей помогут в освоении региона, укреплении в нем присутствия России.
Использование экологически чистых источников получения энергии решит как проблему обеспечения электроэнергией, так и вопрос сохранения природы в этом регионе. Кроме того, использование магнитных подшипников в конструкции позволит повысить эффективность преобразования энергии ветра, так как уменьшатся потери от трения (смазочные материалы в условиях низких температур будут не нужны).
Арктика имеет стратегическое значение для России. Ввиду суровых климатических условий обширное пространство к северу от полярного круга осталось слабо изученным и мало освоенным, а расположенные там сырьевые запасы нетронуты и огромны. Также Арктика рассматривается как альтернативный путь перевозки грузов. Разработки российских изобретателей помогут в освоении региона, укреплении в нем присутствия России.
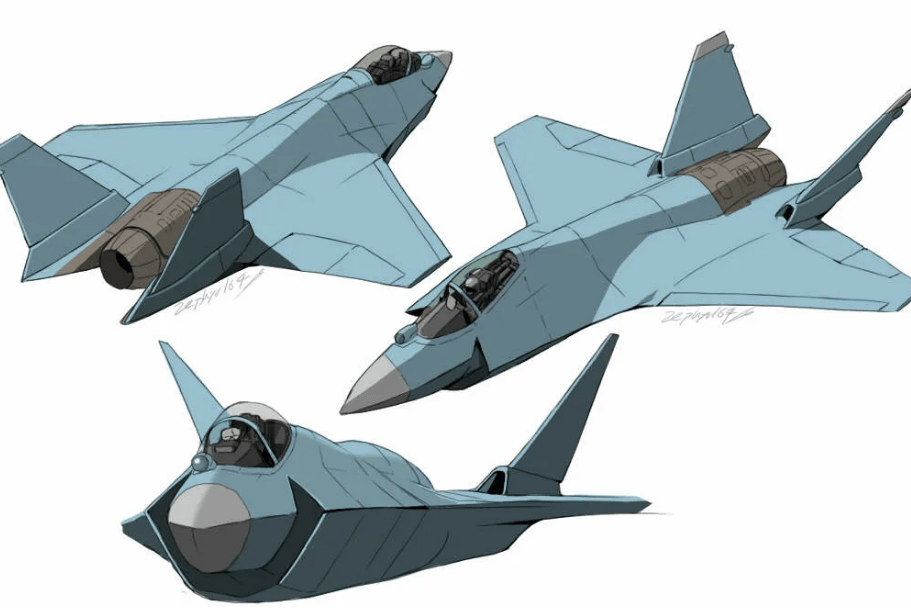
13.03.2022
Опубликован патент на лёгкий тактический истребитель Т-75 "Checkmate"
На сайте ФИПС Роспатента опубликован в открытом доступе патент на истребитель Т-75 под брендом "Checkmate" (перевод с английского "Шах и Мат") . Не можем не отметить звучное название бренда самолета (Чекмэйт), которое наполнено соответствующей смысловой нагрузкой.
С оригинальной публикацией всех материалов патента на сайте ФИПС Роспатента можно ознакомится по ссылке внизу статьи.
В качестве владельца патента указано Акционерное общество "Авиационная холдинговая компания "Сухой" (АО "Компания "Сухой")
Формула изобретения, определяющая объем правовой охраны довольно лаконичная и описывает внешнюю компоновку и управление самолетом, не выдавая секретов его внутреннего устройства:
1. Легкий тактический самолет, содержащий фюзеляж с боковыми хвостовыми балками, консоли крыла, хвостовое оперение, воздухозаборник, силовую установку и поворотное реактивное сопло, отличающийся тем, что боковые хвостовые балки являются развитыми и заканчиваются поворотными на горизонтальной оси частями, на консолях крыльев, имеющих большую стреловидность, располагаются поворотные носки и внутренние и внешние элевоны, а хвостовое оперение выполнено V-образным, консоли которого выполнены цельноповоротными, выполняющими функцию как горизонтального, так и вертикального оперения, причем воздухозаборник располагается в нижней части фюзеляжа и частично его охватывает с нижней стороны.
2. Легкий тактический самолет по п.1, отличающийся тем, что поворотное реактивное сопло располагается по оси симметрии фюзеляжа и используется для управления и балансировки в полете и выполнено отклоняемым в вертикальной плоскости.
3. Легкий тактический самолет по п.1, отличающийся тем, что поворотное реактивное сопло располагается по оси симметрии фюзеляжа и используется для управления и балансировки в полете и выполнено всеракурсным.
4. Легкий тактический самолет по п.1, отличающийся тем, что ось поворота консолей V-образного хвостового оперения расположена перпендикулярно оси фюзеляжа.
5. Легкий тактический самолет по п.4, отличающийся тем, что ось поворота консолей V-образного хвостового оперения располагается ближе к передней кромке консолей.
6. Легкий тактический самолет по п.1, отличающийся тем, что все кромки воздухозаборника выполнены стреловидными.
Истребитель создается с открытой архитектурой, по проекту создателей будет иметь передовую бортовую электронику, в том числе РЛС с АФАР и систему РЭБ нового поколения, система круговой оптической и радиотехнической разведки, встроенная система радиоэлектронных помех, оптическая прицельная система, система широкодиапазонной связи.
Нет результатов, уточните запрос

12.03.2022
Патент на систему борьбы с мошенническими звонками, использующими интеллектуальных ботов
Опубликован патент на систему противодействия нежелательным мошенническим и спам звонкам, в которых используется искусственная речь, синтезируемая компьютерными программами, маскирующими под людей (ссылка на патент внизу публикации).
В настоящий момент практически любой обладатель универсального мобильного устройства (например, мобильного телефона, смартфона, планшета и т.д.) сталкивается с нежелательными звонками, SMS–сообщениями, электронными письмами из банков, медицинских центров, страховых фирм, салонов красоты и других компаний, использующих в своей работе телемаркетинг.
Большинство из этих компаний неявно прописывают распространение рекламы через коммуникационные сети в договоре и тем самым обходят правовые нормы.
Компании, предоставляющие услуги телемаркетинга, активно используют интеллектуальных ботов, которые имитируют в процессе общения людей.
Роботы определяют уровень раздражительности и зачастую специально выстраивают разговор так, чтобы маскировать искусственное происхождение беседы.
Также коммуникационные сети нередко используют мошенники для получения конфиденциальной информации пользователя (например, данных о кредитных картах, номерах социального страхования и т.д.).
Нет результатов, уточните запрос

11.03.2022
Инженеры из BMW анонсируют технологию изменения цвета кузова путем нажатия одной кнопки
В BMW IX Flow изменение цвета кузова легко можно будет осуществить нажатием одной кнопки.
В настоящее время доступны три цвета: белый, черный и серый. Кузов специально разработан и стимулируется электрическими сигналами для изменения цвета экстерьера автомобиля.
Корпус содержит миллионы микрокапсул диаметром, эквивалентным толщине человеческого волоса, которые содержат отрицательные белые пигменты и положительные черные пигменты.
Технология похожа на электронные дисплеи E-Ink, которые имитируют бумажную печать и часто применяются в электронных книгах.
Стимуляция электрическим полем заставляет белые или черные пигменты накапливаться на поверхности микрокапсулы, придавая кузову желаемый оттенок в любой момент времени.
По словам инженеров изобретателей, технология не только эффектна, но и имеет практическое применение. Например, белая поверхность лучше отражает солнечный свет и может предотвратить салон автомобиля от перегрева. Тёмные же тона, наоборот, помогают сохранять тепло в прохладную погоду.
Нет результатов, уточните запрос

10.03.2022
Современные беспилотники: БПЛА «Альбатрос»
Беспилотники «Альбатрос», это отечественные беспилотники которые предназначены для поиска потерявшихся людей в лесу. Также эти беспилотники подойдут для охраны участка или других крупных территорий.Беспилотники «Альбатрос» свободно можно купить в свободном доступе в интернете и купить его себе для развлечений или в путешествия для красивых фото кадров.
Нет результатов, уточните запрос

09.03.2022
Умное устройство для переработки мусора Lasso
Умная мусорка Lasso, а также это устройство называют мини завод по переработке мусора. По виду очень напоминает стиральную машинку или мини холодильник. Суть этого устройства в том,что это как обычная мусорка, только при этом она может его разбирать, тем самым в неё куда больше мусора вмещается, его куда проще будет выкинуть и вес мусора заметно будет меньше, чем он был бы не переработан.
Нет результатов, уточните запрос

08.03.2022
Предприниматели из Москвы могут получить по 75 000 руб. за получение каждого патента в рамках поддержки инноваций
Заявку на компенсацию затрат на патентование можно до 31 мая 2022 года на портале i.moscow Московского инновационного кластера (МИК) .
Подать заявку могут представители малого и среднего бизнеса.
«За патент, зарегистрированный на территории страны в течение последних 12 месяцев, московские предприниматели могут получить по 75 тысяч рублей за каждое свое изобретение. Программа действует с 1 апреля до 31 мая»,сообщила заместитель мэра Москвы Наталья Сергунина.
Сообщается, что получения выплат за патенты полностью автоматизирован.
Подать заявку могут представители малого и среднего бизнеса.
«За патент, зарегистрированный на территории страны в течение последних 12 месяцев, московские предприниматели могут получить по 75 тысяч рублей за каждое свое изобретение. Программа действует с 1 апреля до 31 мая»,сообщила заместитель мэра Москвы Наталья Сергунина.
Сообщается, что получения выплат за патенты полностью автоматизирован.
Для этого достаточно получить статус участника и подать заявку в личном кабинете на платформе i.moscow. В ней нужно указать номер полученного патента.
После проверки с компанией будет подписан договор и состоится перечисление денег на счет организации.
Московский инновационный кластер (МИК) на сайте i.moscow является проектом для внедрения инноваций и развития кооперации между крупными корпорациями, промышленностью, субъектами бизнеса, образовательными и научными организациями, и органами власти.
Московский инновационный кластер (МИК) на сайте i.moscow является проектом для внедрения инноваций и развития кооперации между крупными корпорациями, промышленностью, субъектами бизнеса, образовательными и научными организациями, и органами власти.
В данный момент в МИК входят около 35 тысяч организаций из Москвы и 80-ти регионов России.
МИК курирует столичный Департамент предпринимательства и инновационного развития, а за техническое развитие портала i.moscow отвечает Департамент информационных технологий города Москвы.
Нет результатов, уточните запрос

07.03.2022
Бесплатный вебинар по международному патентованию по системе PCT
12 апреля 2022 года состоится бесплатный вебинар, в котором будут освещены практические вопросы подачи международной заявки в международное патентное ведомство WIPO.
На вебинаре участники получат пояснения и рекомендации по составлению описания и формулы.
Вебинар рассчитан на русскоязычных заявителей, патентных поверенных, патентоведов , изобретателей, а также на студентов, которые интересуются вопросами охраны интеллектуальной собственности.
Мероприятие проводится под руководством Ольги Крысановой, руководителя программ отдела международного сотрудничества (РСТ) сектора патентов и технологий.
Вебинар состоится в 11.00 по Московскому времени и пройдет на русском языке.
На вебинаре участники получат пояснения и рекомендации по составлению описания и формулы.
Вебинар рассчитан на русскоязычных заявителей, патентных поверенных, патентоведов , изобретателей, а также на студентов, которые интересуются вопросами охраны интеллектуальной собственности.
Мероприятие проводится под руководством Ольги Крысановой, руководителя программ отдела международного сотрудничества (РСТ) сектора патентов и технологий.
Вебинар состоится в 11.00 по Московскому времени и пройдет на русском языке.
Нет результатов, уточните запрос

06.03.2022
В России могут частично легализовать пиратские программы
Российские госорганы всерьез обсуждают отмену ответственности за использование пиратских (нелицензионных и/или взломанных) программ, как это следует из документа «План первоочередных действий по обеспечению развития российской экономики в условиях внешнего санкционного давления» от 2 марта 2022 года(см. п. 6.7 Информационнные технологии)
Н данный момент об уходе из России заявили такие компании какMicrosoft (Windows, Word), Acronis, Adobe (Photoshop), Autodesk (Autocad), Cisco, EPAM, SAP, Veeam, Xilinx, Steam, Sony, а также многие другие иностранные сервисы и платформы.
Как следует из документа рассматривается принудительное лицензирование в отношении софта иностранных компаний поддержавших санкции и ввод его в оборот без какого-либо вознаграждения правообладателям.
Н данный момент об уходе из России заявили такие компании какMicrosoft (Windows, Word), Acronis, Adobe (Photoshop), Autodesk (Autocad), Cisco, EPAM, SAP, Veeam, Xilinx, Steam, Sony, а также многие другие иностранные сервисы и платформы.
Как следует из документа рассматривается принудительное лицензирование в отношении софта иностранных компаний поддержавших санкции и ввод его в оборот без какого-либо вознаграждения правообладателям.
Нет результатов, уточните запрос

05.03.2022
Список недружественных стран в которых не будут действовать патентные и авторские права россиян
Кабинет Министров обнулил патенты лиц из недружественных государств
Соответственно, российские патенты и авторские права в результате санкций не будут действовать в перечисленных государствах (см. список ниже).
Соответственно, российские патенты и авторские права в результате санкций не будут действовать в перечисленных государствах (см. список ниже).
Кроме США это все страны Евросоюза ЕС (всего 27 стран), в том числе
Австрия, Германия, Франция, Италия, Бельгия, Финляндия, Польша, Венгрия, Швеция, Чехия, Нидерланды. А также Великобритания, Норвегия, Республика Корея, Сингапур, Тайвань, Швейцария.
Япония. Полный список смотрите по ссылке ниже.
Австрия, Германия, Франция, Италия, Бельгия, Финляндия, Польша, Венгрия, Швеция, Чехия, Нидерланды. А также Великобритания, Норвегия, Республика Корея, Сингапур, Тайвань, Швейцария.
Япония. Полный список смотрите по ссылке ниже.
Нет результатов, уточните запрос

05.03.2022
Мишустин умножил на ноль патенты недружественных государств
Кабинет Министров РФ в лице Михаила Владимировича Мишустина разрешило не выплачивать компенсации владельцам патентов из недружественных стран (полный список см. по ссылке).
В законодательстве РФ есть статья, по которой, в случае необходимости, владельца патента можно принудить к выдаче лицензии на использование патента при условии выплаты ему компенсации (см. ст. 1462 ГК РФ ч.4).
Кабмин внёс ряд изменений в методику определения компенсаций, выплачиваемых правообладателю при решении использовать изобретение без его согласия.
В соответствии с принятыми изменениями, размер выплаты патентовладельцам из недружественных стран составляет 0 % выручки от производства и реализации товаров, выполнения работ и оказания услуг, если для этого использованы соответствующие патенты на изобретения, патенты на полезные модели или патент на промышленный образец.
В законодательстве РФ есть статья, по которой, в случае необходимости, владельца патента можно принудить к выдаче лицензии на использование патента при условии выплаты ему компенсации (см. ст. 1462 ГК РФ ч.4).
Кабмин внёс ряд изменений в методику определения компенсаций, выплачиваемых правообладателю при решении использовать изобретение без его согласия.
В соответствии с принятыми изменениями, размер выплаты патентовладельцам из недружественных стран составляет 0 % выручки от производства и реализации товаров, выполнения работ и оказания услуг, если для этого использованы соответствующие патенты на изобретения, патенты на полезные модели или патент на промышленный образец.
Нет результатов, уточните запрос

05.03.2022
Иностранные табачные бренды покидают Россию
Табачное лобби уходит из России
К санкциям против России присоединилось все крупные табачные компании, так называемый конгломерат компаний Big Tobacco (табачное лобби), а именно:
British American Tobacco BAT (товарные знаки Dunhill, Kent, Pall Mall, Lucky Strike, Rothmans, Vogue, Lucky Strike, ЯВА устройства для нагревания табака GLO)
К санкциям против России присоединилось все крупные табачные компании, так называемый конгломерат компаний Big Tobacco (табачное лобби), а именно:
British American Tobacco BAT (товарные знаки Dunhill, Kent, Pall Mall, Lucky Strike, Rothmans, Vogue, Lucky Strike, ЯВА устройства для нагревания табака GLO)
Нет результатов, уточните запрос

05.03.2022
В России прекратили деятельность около 350 иностранных брендов и компаний. Имущество и активы компаний
Президент России В. В. Путин призвал правительство к решительным действиям в отношении тех компаний, которые уходят из страны и взять их под внешнее управление (национализировать)
ПодробнееНет результатов, уточните запрос

05.03.2022
Илон Маск и чипирование мозга в стиле Cyberpunk 2077
Миллиардер, визионер и звезда Twitter Илон Маск недавно заявил о планах Neuralink, разрабатывающей нейрочипы, приступить к испытаниям на людях.
До этого компания с помощью своего устройства «научила» обезьяну играть в видеоигры.
Маск уже обещал начать такие испытания на людях в 2020-м и в 2021 году.
Кроме того, за последнее время из Neuralink уволились несколько значимых сотрудников. Рассказываем, что происходит в компании сейчас и за что ее критикуют инженеры, нейропсихологи и потенциальные пользователи
До этого компания с помощью своего устройства «научила» обезьяну играть в видеоигры.
Маск уже обещал начать такие испытания на людях в 2020-м и в 2021 году.
Кроме того, за последнее время из Neuralink уволились несколько значимых сотрудников. Рассказываем, что происходит в компании сейчас и за что ее критикуют инженеры, нейропсихологи и потенциальные пользователи

04.03.2022
Корейский дизайнер создал «третий глаз» для любителей залипать в смартфоны на ходу
28-летний изобретатель из Южной Кореи разработал механическое глазное яблоко, или «третий глаз». Пользователи мобильных телефонов могут закрепить его на лбу, и просматривать Интернет без травм на ходу.
"Глаз" включает, несколько датчиков, в том числе гироскоп, камеру и ультразвуковой датчик, которые обнаруживают препятствия впереди и предупреждает пользователя.
"Глаз" включает, несколько датчиков, в том числе гироскоп, камеру и ультразвуковой датчик, которые обнаруживают препятствия впереди и предупреждает пользователя.
Картинка с камеры "глаза" может быть выведена на экран смартфона через блютуз или другие средства связи

04.03.2022
Европейское патентное ведомство отказалось от сотрудничества с патентными ведомствами РФ, Белоруссии и Евразийским ведомством
Европейское патентное ведомство (EPO) приостановило сотрудничество с патентными ведомствами России (Роспатентом), патентным ведомством Белоруссии и Евразийской патентной организацией (ЕАПО) в связи с ситуацией на Украине.
Таким образом, сотрудничество в сфере патентов и товарных знаков будет приостановлено. Срок приостановки сотрудничества не оговаривается, но делается примечание о возможных иных мерах и последствиях для РФ и Белоруссии.
Возможно россиянам будет недоступна глобальная поисковая система Esp@snet и другие сервисы EPO, в том числе поиск по товарным знакам. Присоединится ли к санкциям международное патентное ведомство всемирной организации интеллектуальной собственности WIPO, пока не известно.
Про то, какое именно сотрудничество осуществлялось с EPO смотрите информацию на сайте Роспатента
Таким образом, сотрудничество в сфере патентов и товарных знаков будет приостановлено. Срок приостановки сотрудничества не оговаривается, но делается примечание о возможных иных мерах и последствиях для РФ и Белоруссии.
Возможно россиянам будет недоступна глобальная поисковая система Esp@snet и другие сервисы EPO, в том числе поиск по товарным знакам. Присоединится ли к санкциям международное патентное ведомство всемирной организации интеллектуальной собственности WIPO, пока не известно.
Про то, какое именно сотрудничество осуществлялось с EPO смотрите информацию на сайте Роспатента

03.03.2022
Россия может пренебречь патентными и авторскими правами недружественных государств (ч.2)
Следим за тем как развиваются события в информационно-технологической войне, результатом которой вполне может быть отмена патентных или авторских прав ряда государств на территории Российской Федерации или же, в крайнем варианте полный слом патентной системы или ее трансформация в региональную систему по образцу СССР.
Как мы и полагали корпорация Microsoft под давлением правительства США отказалась от поддержки своих продуктов в России, в том числе Windows и Word. В связи с чем мы рекомендуем читателям сохранить свои данные и отключить обновления. Подробнее об этом смотрите в статье по ссылке ниже в нашем Яндекс Дзен в "Подробнее".
Как мы и полагали корпорация Microsoft под давлением правительства США отказалась от поддержки своих продуктов в России, в том числе Windows и Word. В связи с чем мы рекомендуем читателям сохранить свои данные и отключить обновления. Подробнее об этом смотрите в статье по ссылке ниже в нашем Яндекс Дзен в "Подробнее".

02.03.2022
Россия может пренебречь патентными и авторскими правами недружественных государств (ч.1)
В российских СМИ активно обсуждается возможность использовать патенты и авторские права иностранных государств без согласия авторов и правообладателей. Постараемся вкратце объяснить почему эта тема сейчас актуальна и к чему может привести противостояние России и иностранных государств в данной сфере.
Первая, на наш взгляд, актуальная причина в том, что у российских производителей нет полностью своей операционной системы. Все операционные системы основаны на дополненном и/или переработанном коде Linux c лицензией Open Source. Вторую причину смотрите на нашем Яндекс Дзен, ссылка в "Подробнее"
Первая, на наш взгляд, актуальная причина в том, что у российских производителей нет полностью своей операционной системы. Все операционные системы основаны на дополненном и/или переработанном коде Linux c лицензией Open Source. Вторую причину смотрите на нашем Яндекс Дзен, ссылка в "Подробнее"

01.03.2022
Microsoft сделал заявление о прекращении продаж и обслуживания Windows, Word и других продуктов в Росиии.
Брэд Смит (президент компании) утверждает, что сотрудники Microsoft "опечалены и подавлены и возмущены сообщениями и новостями о войне на Украине", в связи с чем Microsoft сообщила о приостановке продажи своих продуктов и предоставления услуг на территории РФ.
Брэд Смит в официальном блоге корпорации осудил действия России, назвав их неоправданными, незаконными и ничем не спровоцированным вторжением.
Брэд Смит в официальном блоге корпорации осудил действия России, назвав их неоправданными, незаконными и ничем не спровоцированным вторжением.

23.02.2022
В России могут запретить платежные системы Samsung Pay, Apple Pay и Google Pay
Арбитражный суд Москвы принял решение о запрете ввоза и продажи и предложений к продаже в РФ 61 модели смартфонов компании Samsung, по заявлению компании Sqwin SA, зарегистрированной в Швейцарии и имеющей патент на изобретение Online Transaction System - Система электронных платежей» (Международная заявка ).
Выданный в РФ на основании международной заявки WO2014095362A1 патент имеет номер RU2686003C2 . Автором патента является Виктор Гульченко .
Патентные права, по мнению истца и суда, нарушает сервис Samsung Pay и смартфоны с данной системой
Опасность аналогичных претензий по патенту грозит также сервисам Apple Pay и Google Pay.
Выданный в РФ на основании международной заявки WO2014095362A1 патент имеет номер RU2686003C2 . Автором патента является Виктор Гульченко .
Патентные права, по мнению истца и суда, нарушает сервис Samsung Pay и смартфоны с данной системой
Опасность аналогичных претензий по патенту грозит также сервисам Apple Pay и Google Pay.
Нет результатов, уточните запрос

21.02.2022
Клавиатура "перчатки" Glove80.
Такое название появилась от внешнего вида устройства, которое очень напоминает пару перчаток.
"Перчатки" разрабатывались около 5 лет и прошли более 500 тестов.
В такой клавиатуре около 80 клавиш, по 40 на одну перчатку.
Весит клавиатура всего 600 грамм, выполнена в 2-ух цветах - чёрном и белом.
Клавиатуру также можно подключить на любое устройство имеющее Bluetooth.
Из-за её легкости и компактности "перчаток" ИХ можно легко взять с собой в дорогу, например в сумке от ноутбука.

20.02.2022
Alt Motion Controler- замена игровой клавиатуры?
Недавно один из бывших дизайнеров Razer Эдвард Ларкин вместе со своей компанией анонсировал контролер будущего. По словам Эдвард Ларкина, это устройство перевернет игровую индустрию. Само устройство напоминает джостик, и имеет классические ручки, а по середине джостика стоит стик.
Хоть Эдвард и собирается перевернуть игровую индустрию своим творением, он считает что полноценной заменой клавиатуры джостик не станет.
20.02.2022
Суды и Роспатент отказал Навальному по "умному голосованию" со ссылкой на товарный знак №823798
"Умное голосование" блокировка поисковой выдачи по забросу "Умное голосование" по официальной версии состоялось по обращению владельца одноименного товарного знака номер 823798 зарегистрированного на ООО "Вулинтертрейд"

20.02.2022
Apple сделали наушники с обратной связью
Apple сделали наушники, которые будут использовать датчики и акселерометры для сбора информации об ориентации пользователя в пространстве. Это позволит улучшить интерактивную связь пользователей на спортивных симуляторах, а также в играх

18.02.2022
OS Google Flex для компьютеров, на которых тормозит Windows
Интернет монополист - компания Google запускает новую систему
Новая OS Google Flex была разработана на основе интеллектуальной собственности компании Neverware, создавшей OS Cloudready.
Компанию Neverware Google купил около 2-х лет года назад .
На основе OS Cloudready и была создана Google Chrome Flex.
18.02.2022
Илон Маск разрабатывает нейрочипы для мозга.
В последнее время из компании Neuralink уволились несколько довольно известных сотрудников, что возможно это связано с этическими моментами в связи с испытаниями чипирования на людях. Ранее подобный чип успешно был опробован на обезъяне, которую с его помощью начули играть в компьютерные игры
Нет результатов, уточните запрос

15.02.2022
Китай присоединился к международному патентованию дизайна.
За 2020 г. в Китае было подано более 750 000 заявок на получение патентов на промобразцы, что составляло около 55% от заявок на данный вид патентов в мире.
Присоединение Китая к системе международного патентования промышленного дизайна значительно упростит охрану китайским производителям и изобретателям в большинстве стран участников данной системы.
Следует отметить, что Китай также давно занимает первые места по подаче патентов на изобретения и полезные модели.
Нет результатов, уточните запрос

12.02.2022
Стала доступна инструкция по поиску товарных знаков (торговых марок) по международной базе WIPO и базам Патентных Ведомств разных стран
Руководство по использованию мировых баз данных
по товарным знакам доступно для скачивания по ссылке. https://disk.yandex.ru/i/pjzohuYvMa39jg или по QR коду (см. изображение)
Особенно интересен раздел посвященный поиску по базе данных Международного Патентного Ведомства WIPO

06.02.2022
Конкурс на самый лучший патент
Роспатент объявляет конкурс «Успешный патент» по выбору лучших изобретений, по экономическому эффекту в 2021 году.
В конкурсе участвовали отечественные изобретатели, имеющие патенты на изобретение, выданные в 2020-2021 годах.
Претенденты подают заявки на сайте Роспатента в электронной форме .
Срок подачи заявки - с 1 по 28 февраля 2022 года.
В конкурсе участвовали отечественные изобретатели, имеющие патенты на изобретение, выданные в 2020-2021 годах.
Претенденты подают заявки на сайте Роспатента в электронной форме .
Срок подачи заявки - с 1 по 28 февраля 2022 года.
Нет результатов, уточните запрос

05.02.2022
Создан компьютерный чип,который может самостоятельно менять свою конфигурацию.
Прогресс ускоряется и сюжеты фильмов "Матрица и "Терминатор" уже не кажутся нам фантастическими. Группа инженеров создала чип, который способен сам изменять свою конфигурацию по мере необходимости.
Подробнее Принцип технологии заимствован на алгоритмах работы мозга человека и по замыслу создателей может помочь искусственным интеллектам в самообучении =. В железе изобретение выглядит как прямоугольная деталь из никелата перовскита материала, который очень чувствителен к водороду, за счет чего схема на его основе может самопроизвольно перепрограмироваться .
Таким образом, искусственному интеллекту предоставляется возможность модифицировать микросхемы под его управлением.
Нет результатов, уточните запрос

04.02.2022
Роспатент и Сколково создать "экосистему интеллектуальной собственности"
Довольно размытая, но интересная концепция для поддержки в создании и получении патентов и "рынка интеллектуальной собственности" появилась на сайтах ФИПС Роспатента и Сколково
https://rospatent.gov.ru/ru/sourses/multimedia/video/science-day-08022022
https://sk.ru/news/patentnaya-analitika/
https://sk.ru/news/patentnaya-analitika/
Возможно авторы концепции имеют ввиду поддержку изобретателей и малого бизнеса, а может быть и усиление контроля государства в данной сфере. Попробуем разобраться.
Нет результатов, уточните запрос

28.01.2022
Эксперты Роспатента рассказали, на какие какие именно лекарства чаще всего подают патенты на изобретения в России
Эксперты Роспатента рассказали, на какие какие именно лекарства чаще всего подают патенты на изобретения в России
Подробнее
28.01.2022
Баггикоптер для экстремалов
Шведы из компании Jetson сообщили о выпуске eVTOL-коптера под торговой маркой Jetson ONE. Аппарат позиционируется, как летающий багги «для настоящих хулиганов».
ПодробнееКоптер из-за ограничений по времени полета не предназначен ни для какой полезной деятельности, но при этом стоит более 90 000$.
Однако управлять им можно без лицензии пилота, для чего машину и создавали.
Конструкция Jetson ONE предельно примитивна, нет приборной панели и ее заменяет смартфон пилота.
Конструкция Jetson ONE предельно примитивна, нет приборной панели и ее заменяет смартфон пилота.
По сути это гибрид коптера и багги к способный поднять одного человека, весом не более 120 кг.
Максимальная скорость соствляет не выше 100 км/ч, потолок высоты 500 м.
Есть сканер-лидар при критически низкой высоте автоматически замедляющий скорость .
Длительность полета, составляет всего 20 минут на одном заряде батарей, но производитель обещает повысить этот показатель
Длительность полета, составляет всего 20 минут на одном заряде батарей, но производитель обещает повысить этот показатель

28.01.2022
Искусственный интеллект обучают управлять ядерными реакторами
Искусственный интеллект обучают управлять процессами в ядерных реакторах, причем разработки ведутся одновременно в нескольких странах. Компания DeepMind, при поддерке Google, Alphabet обучила нейросеть ИИ управлять плазмой внутри реактора ядерного синтеза, типа токамак.
ПодробнееПоиск способов контроля и удержания под контролем раскаленной плазмы, может раскрыть потенциал ядерного синтеза, который ученые считают чистым источником энергии будущего.
В звездах, также происходят процессы термоядерного синтеза, но при этом гравитационной массы звезды достаточно, чтобы атомы водорода притянулись друг к другу и преодолели свои противоположные заряды.
В звездах, также происходят процессы термоядерного синтеза, но при этом гравитационной массы звезды достаточно, чтобы атомы водорода притянулись друг к другу и преодолели свои противоположные заряды.
В реакторах ученые используют огромные магнитные катушки, чтобы создать гравитационное поле и ограничить реакцию поля частиц ядерного синтеза и придавая ему нужную форму.
Работу катушек и расположение массы частиц необходимо тщательно контролировать, чтобы плазма не касалась стен токамака.
Но каждый раз, когда ученые хотят хотя бы немного изменить конфигурацию плазмы и опробовать различные ее формы, которые могут дать больше энергии, то это требует огромного объема инженерной и конструкторской работы.
DeepMind уже разработал нейросеть, которая может управлять плазмой автономно. Инженеры DeepMind научили систему глубокого обучения управлять двадцатью магнитными катушками внутри токамака с изменяемой конфигурацией в Швейцарском плазменном центре.
В РФ работа подобных научных центров носит закрытый характер, но то, что попадает в открытый доступ, впечатляет специалистов. Участники конференции «Искусственный интеллект: проблемы и пути решения» высоко оценили доклады представителей Курчатовского института и выступление ректора МФТИ, члена-корреспондента РАН Н. Н. Кудрявцева на итоговом пленарном заседании.
На базе МФТИ создается Центр Национальной технологической инициативы по сквозной технологии «Искусственный интеллект». В НИЦ «Курчатовский институт» развивается направление робототехники и проводятся исследования в области искусственных нейронных сетей.
Развитием цифровых технологий в области АСУ ТП занимаются также АО «РАСУ», ФГУП «ФНПЦ НИИИС им. Ю. Е. Седакова», ФГУП «ВНИИА», ФГУП «ПСЗ», ООО «Московский физприбор», ФГУП «РФЯЦ-ВНИИТФ им. Е. И. Забабахина», АО «СНИИП», НИЦ «Курчатовский институт», и другие научные центры.
Но каждый раз, когда ученые хотят хотя бы немного изменить конфигурацию плазмы и опробовать различные ее формы, которые могут дать больше энергии, то это требует огромного объема инженерной и конструкторской работы.
DeepMind уже разработал нейросеть, которая может управлять плазмой автономно. Инженеры DeepMind научили систему глубокого обучения управлять двадцатью магнитными катушками внутри токамака с изменяемой конфигурацией в Швейцарском плазменном центре.
В РФ работа подобных научных центров носит закрытый характер, но то, что попадает в открытый доступ, впечатляет специалистов. Участники конференции «Искусственный интеллект: проблемы и пути решения» высоко оценили доклады представителей Курчатовского института и выступление ректора МФТИ, члена-корреспондента РАН Н. Н. Кудрявцева на итоговом пленарном заседании.
На базе МФТИ создается Центр Национальной технологической инициативы по сквозной технологии «Искусственный интеллект». В НИЦ «Курчатовский институт» развивается направление робототехники и проводятся исследования в области искусственных нейронных сетей.
Развитием цифровых технологий в области АСУ ТП занимаются также АО «РАСУ», ФГУП «ФНПЦ НИИИС им. Ю. Е. Седакова», ФГУП «ВНИИА», ФГУП «ПСЗ», ООО «Московский физприбор», ФГУП «РФЯЦ-ВНИИТФ им. Е. И. Забабахина», АО «СНИИП», НИЦ «Курчатовский институт», и другие научные центры.

29.01.2022
В РФ мигрантов оснастят чипироваными картами
Трудовые мигранты в РФ с 2022 года начнут получать патенты (разрешения) на работу в форме чипированной карты с чипом, содержащим фото отпечатки пальцев, серию и номер патента, ФИО ее дата рождения, гражданство, серия и номер паспорта, профессия и место работы, ИНН владельца. выдан патент.
ПодробнееНет результатов, уточните запрос
Новости декабрь 2021

30.12.2021
Президент РФ Владимир Путин подписал закон, вносящий изменения в регулирование деятельности патентных поверенных.
Документ опубликован на официальном портале правовой информации.
Закон принят Госдумой 14 декабря, одобрен Советом Федерации 15 декабря.
Закон направлен на создание больших правовых гарантий соблюдения прав клиента патентного поверенного и беспрепятственной деятельности самих поверенных. Так, патентные поверенные будут пользоваться правом доступа к информационным системам Роспатента и правом запрашивать у государственных органов, органов местного самоуправления и организаций сведения, необходимые для выполнения поручения доверителя.
Вводится новый вид охраняемой законом профессиональной тайны – тайна патентного поверенного.
ПодробнееЗакон принят Госдумой 14 декабря, одобрен Советом Федерации 15 декабря.
Закон направлен на создание больших правовых гарантий соблюдения прав клиента патентного поверенного и беспрепятственной деятельности самих поверенных. Так, патентные поверенные будут пользоваться правом доступа к информационным системам Роспатента и правом запрашивать у государственных органов, органов местного самоуправления и организаций сведения, необходимые для выполнения поручения доверителя.
Вводится новый вид охраняемой законом профессиональной тайны – тайна патентного поверенного.

29.30.2021
в Роспатент поступило уже 100 заявок на государственную регистрацию географических указаний
С момента вступления в силу Федерального закона № 230-ФЗ от 26 июля 2019 года, благодаря которому в Гражданском кодексе РФ появился новый объект интеллектуальных прав – «географическое указание» (ГУ), в Роспатент поступило уже 100 заявок на государственную регистрацию ГУ. При этом большая часть заявок подана в электронном виде.
100-я заявка на обозначение «ФЕДОСИХИНСКИЕ ПЕЛЬМЕНИ» (№2021783966) подана заявителем из Новосибирской области. Примечательно, что ранее, 1-2 декабря 2021 года Роспатент провел в Новосибирске на площадке Новосибирского государственного технического университета (НГТУ НЭТИ) обучающий семинар «Региональные бренды России – новые точки роста».
Подробнее100-я заявка на обозначение «ФЕДОСИХИНСКИЕ ПЕЛЬМЕНИ» (№2021783966) подана заявителем из Новосибирской области. Примечательно, что ранее, 1-2 декабря 2021 года Роспатент провел в Новосибирске на площадке Новосибирского государственного технического университета (НГТУ НЭТИ) обучающий семинар «Региональные бренды России – новые точки роста».

27.12.22
В Роспатент поступила 100 000-ная заявка на регистрацию товарного знака
В Роспатент поступила 100 000-ная заявка на регистрацию товарного знака. Заявка №2021782873 подана индивидуальным предпринимателем Серовой Татьяной Владимировной. На регистрацию подано комбинированное обозначение со словесным элементом «сеть ветеринарных клиник и аптек». На данный момент заявка находится на стадии формальной экспертизы.
Подробнее15.12.22
Ученые центра эпидемиологии и микробиологии имени Н.Ф. Гамалеи получили патент на решение, относящееся к использованию вакцины у детей старше месяца.
Запатентованное решение представляет собой использование иммунобиологического средства, обеспечивающего развитие реакций гуморального и клеточного иммунного ответа против вируса SARS-CoV-2 у детей старше 1 месяца. Одним из авторов патента является Ольга Попова. Ссылка на патент №2761904
ПодробнееНет результатов, уточните запрос

15.03.2022
Революционизирующие квантовые схемы: точное проектирование с использованием графена
Ученые из CiQUS, ICN2, Университета Кантабрии, DIPC и DTU объединяют усилия для разработки универсального метода построения углеродных наноцепей по кирпичикам с настраиваемыми свойствами.
Возможные области применения включают будущие электронные устройства, схемы для квантовых компьютеров и термоэлектрические наноматериалы для возобновляемых источников энергии.
Представьте, что у вас есть здание, сделанное из штабелей кирпичей, соединенных адаптируемыми мостами. Вы нажимаете на ручку, которая изменяет мосты, и здание меняет функциональность. Разве это не было бы здорово?
Команда исследователей во главе с проф. Айтор Мугарза из Каталонского института нанонауки и нанотехнологий (ICN2) и ICREA вместе с профессором Дж. Диего Пенья из Центра исследований в области биологической химии и молекулярных материалов Университета Сантьяго-де-Кампостела (CiQUS-USC), д-р Сезар Морено, бывший член команды ICN2, а в настоящее время научный сотрудник Университета Кантабрии, и д-р Аран Гарсия-Лекуэ из Международного физического центра Доностиа (DIPC) и Фонда Икербаску, сделали нечто аналогичное, но в масштабе одного атома, с целью синтеза нового углерода -материалы на основе с настраиваемыми свойствами.
Как объясняется в статье, только что опубликованной в Журнале Американского химического общества (JACS) и размещенной на обложке номера, это исследование является значительным прорывом в точном проектировании атомно-тонких материалов, называемых “2D материалами” из-за их уменьшенной размерности. Предлагаемая технология изготовления открывает захватывающие новые возможности для материаловедения и, в частности, для применения в передовой электронике и будущих решениях для устойчивой энергетики.
JACS апрель 2023
Результаты исследования были опубликованы на обложке журнала Американского химического общества (JACS). Авторы: доктор Мария Тенорио и Дамасо Торрес · ICN2
Авторы этого исследования синтезировали новую нанопористую графеновую структуру, соединив ультраузкие графеновые полоски, известные как “нановолокна”, с помощью гибких “мостиков”, изготовленных из фениленовых фрагментов (которые являются частями более крупных молекул). Постоянно изменяя архитектуру и угол наклона этих мостов, ученые могут контролировать квантовую связь между каналами из нановолокон и, в конечном счете, точно настраивать электронные свойства графеновой наноархитектуры. Возможность настройки также может контролироваться внешними стимулами, такими как напряжение или электрические поля, что открывает возможности для различных применений.
Эти новаторские результаты, полученные в результате сотрудничества между ведущими испанскими институтами (CiQUS, ICN2, Университет Кантабрии, DIPC) и Техническим университетом Дании (DTU), показывают, что предложенная стратегия молекулярных мостов может оказать большое влияние на синтез новых материалов с индивидуальными свойствами и является мощным инструментом для реализации квантовых схем. Они выполняют операции, аналогичные операциям обычных схем, хотя в отличие от последних, квантовые схемы используют квантовые эффекты и явления. Проектирование и реализация этих систем чрезвычайно важны для разработки квантовых компьютеров.
Но потенциальные применения подхода, предложенного в этом исследовании, выходят за рамки будущих электронных устройств и компьютеров. Фактически, это также может привести к разработке термоэлектрических наноматериалов, которые могут оказать важное влияние на производство возобновляемой энергии и утилизацию отработанного тепла, тем самым решая еще одну важную социальную проблему.
Ссылка: “Разработка молекулярных мостов для настройки квантового электронного транспорта и анизотропии в нанопористом графене” Сесара Морено, Ксабье Диаса де Керио, Мануэля Вилас-Варелы, Марии Тенорио, Ане Сарасолы, Мадса Брэндбиге, Диего Пенья, Арана Гарсия-Лекуэ и Айтора Мугарзы, 29 марта 2023, Журнал Американского химического общества.
DOI: 10.1021 / jacs.3c00173
Возможные области применения включают будущие электронные устройства, схемы для квантовых компьютеров и термоэлектрические наноматериалы для возобновляемых источников энергии.
Представьте, что у вас есть здание, сделанное из штабелей кирпичей, соединенных адаптируемыми мостами. Вы нажимаете на ручку, которая изменяет мосты, и здание меняет функциональность. Разве это не было бы здорово?
Команда исследователей во главе с проф. Айтор Мугарза из Каталонского института нанонауки и нанотехнологий (ICN2) и ICREA вместе с профессором Дж. Диего Пенья из Центра исследований в области биологической химии и молекулярных материалов Университета Сантьяго-де-Кампостела (CiQUS-USC), д-р Сезар Морено, бывший член команды ICN2, а в настоящее время научный сотрудник Университета Кантабрии, и д-р Аран Гарсия-Лекуэ из Международного физического центра Доностиа (DIPC) и Фонда Икербаску, сделали нечто аналогичное, но в масштабе одного атома, с целью синтеза нового углерода -материалы на основе с настраиваемыми свойствами.
Как объясняется в статье, только что опубликованной в Журнале Американского химического общества (JACS) и размещенной на обложке номера, это исследование является значительным прорывом в точном проектировании атомно-тонких материалов, называемых “2D материалами” из-за их уменьшенной размерности. Предлагаемая технология изготовления открывает захватывающие новые возможности для материаловедения и, в частности, для применения в передовой электронике и будущих решениях для устойчивой энергетики.
JACS апрель 2023
Результаты исследования были опубликованы на обложке журнала Американского химического общества (JACS). Авторы: доктор Мария Тенорио и Дамасо Торрес · ICN2
Авторы этого исследования синтезировали новую нанопористую графеновую структуру, соединив ультраузкие графеновые полоски, известные как “нановолокна”, с помощью гибких “мостиков”, изготовленных из фениленовых фрагментов (которые являются частями более крупных молекул). Постоянно изменяя архитектуру и угол наклона этих мостов, ученые могут контролировать квантовую связь между каналами из нановолокон и, в конечном счете, точно настраивать электронные свойства графеновой наноархитектуры. Возможность настройки также может контролироваться внешними стимулами, такими как напряжение или электрические поля, что открывает возможности для различных применений.
Эти новаторские результаты, полученные в результате сотрудничества между ведущими испанскими институтами (CiQUS, ICN2, Университет Кантабрии, DIPC) и Техническим университетом Дании (DTU), показывают, что предложенная стратегия молекулярных мостов может оказать большое влияние на синтез новых материалов с индивидуальными свойствами и является мощным инструментом для реализации квантовых схем. Они выполняют операции, аналогичные операциям обычных схем, хотя в отличие от последних, квантовые схемы используют квантовые эффекты и явления. Проектирование и реализация этих систем чрезвычайно важны для разработки квантовых компьютеров.
Но потенциальные применения подхода, предложенного в этом исследовании, выходят за рамки будущих электронных устройств и компьютеров. Фактически, это также может привести к разработке термоэлектрических наноматериалов, которые могут оказать важное влияние на производство возобновляемой энергии и утилизацию отработанного тепла, тем самым решая еще одну важную социальную проблему.
Ссылка: “Разработка молекулярных мостов для настройки квантового электронного транспорта и анизотропии в нанопористом графене” Сесара Морено, Ксабье Диаса де Керио, Мануэля Вилас-Варелы, Марии Тенорио, Ане Сарасолы, Мадса Брэндбиге, Диего Пенья, Арана Гарсия-Лекуэ и Айтора Мугарзы, 29 марта 2023, Журнал Американского химического общества.
DOI: 10.1021 / jacs.3c00173
Нет результатов, уточните запрос
Патентные Технологии